РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ЛОКОМОТОРНОЙ ТЕРАПИИ В ОСТРОМ ПЕРИОДЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА
Секция: 4. Медицинские науки

XVII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ЛОКОМОТОРНОЙ ТЕРАПИИ В ОСТРОМ ПЕРИОДЕ ЦЕРЕБРАЛЬНОГО ИНСУЛЬТА
Введение.
Церебральный инсульт является одной из ведущих причин смертности и инвалидизации. В Якутии средний возраст пациентов, перенесших инсульт, составляет 60,5 лет [1]. Очаговая симптоматика при инсульте включает двигательные (гемипарез, атаксия, дисфагия), чувствительные (гемигипестезия, гемианопсия), когнитивные (амнезия, апраксия, агнозия) и эмоционально-волевые (апатия, депрессия, агрессия) нарушения. Восстановление данных нарушений зависит от многих факторов. Например, одним из важнейших предикторов исхода является первоначальная тяжесть инсульта: если при легком дефиците восстановление происходит в течение первых нескольких недель и прогноз в целом очень благоприятный, то при исходно тяжелых инсультах регресс нарушений происходит в течение нескольких месяцев и степень восстановления сильно варьирует [2]. F. Binkofski, R.J. Seitz и T. Hacklander в своём исследовании пришли к выводу, что уменьшение двигательных нарушений на 20 % на протяжении первых 4 недель ассоциируется с хорошим исходом. Помимо тяжести инсульта к числу факторов, влияющих на восстановление постинсультных нарушений и эффективность реабилитации, относятся возраст и особенности личности пациента, его функциональное состояние до инсульта, генетические факторы, тяжесть когнитивных нарушений, осложнения и сопутствующие заболевания, проводимое лечение и социальная поддержка, объём и локализация инфаркта мозга и результаты некоторых дополнительных исследований, таких как магнитно-резонансная спектроскопия и сенсомоторные вызванные потенциалы [3].
Ключевые принципы постинсультной реабилитации включают функциональный подход, частые и интенсивные тренировки, направленные на конкретные задачи, и начало в первые дни или недели после инсульта.
В основе целей нейрореабилитации лежат современные представления о нейропластическом потенциале на нескольких уровнях центральной нервной системы (ЦНС), включая сенсомоторную кору, подкорковые сети и спинной мозг. Синтез данных доклинических и клинических исследований свидетельствует о том, что в восстановлении мозга после инсульта принимают участие множество механизмов, таких как изменения в системах нейромедиаторов и ростовых факторов. Биологические цели, воздействие на которые может положительно влиять на восстановление после инсульта, помимо ЦНС, по-видимому, должны включать скелетные мышцы и метаболические процессы. Например, в мышцах паретичных конечностей происходят дегенеративные изменения, которые могут играть самостоятельную роль в ограничениях жизнедеятельности и, следовательно, должны учитываться при реабилитации [4].
Тренировки ходьбы на бегущей дорожке с облегчением движений паретичной ноги (соматосенсорная стимуляция) сопровождаются появлением нормальных паттернов активации коры, сходных с выявляемыми при обычной ходьбе у здоровых людей. Однако тренировки без облегчения движений паретичной ноги, напротив, ассоциировались с патологическими паттернами активации [5]. Эти наблюдения указывают на то, что определенные методы физической реабилитации могут уменьшать патологическую активацию мозга. Можно предположить, что повторное воспроизведение нормального паттерна активации головного мозга способствует его закреплению со стойким улучшением функции.
Цель исследования.
Изучить результаты локомоторной терапии в острой стадии церебрального инсульта.
Материал и методы исследования.
Проведен ретроспективный анализ динамики неврологического дефицита у пациентов в острой стадии церебрального инсульта, получивших курс реабилитационной локомоторной терапии. Группа обследования состояла из пациентов, госпитализированных в Региональный сосудистый центр (Якутск) в течение 2013 г., с ишемическим или геморрагическим инсультом в острой стадии. Для постановки диагноза всем пациентам проведено общеклиническое обследование, нейровизуализация (КТ или МРТ головного мозга), ультразвуковое исследование церебральных сосудов и сердца, консультация кардиолога. Всем пациентам проведен неврологический осмотр в динамике с использованием шкал Glasgow, NIHSS, Рэнкин, Ривермид.
Для оценки исходной тяжести инсульта использовали шкалы NIHSS и Glasgow. Шкалу Glasgow использовали для оценки степени нарушения сознания. Интерпретация полученных результатов была проведена следующим образом: 15 баллов — сознание ясное, 10—14 баллов — умеренное и глубокое оглушение, 8—9 баллов — сопор, 6—4 балла — кома, 3 балла — гибель коры головного мозга. Шкалу NIHSS использовали для определения степени выраженности очаговой и общемозговой симптоматики. Оценивались следующие параметры: уровень сознания (бодрствование, ответы на вопросы, выполнение команд); зрительные функции (движения глазных яблок, нарушения зрения); двигательные нарушения; координаторные нарушения; нарушения чувствительности (по гемитипу); аутотопоанозогнозия; речевые нарушения (дизартрия, афазия). Оценка менее 10 баллов была расценена как благоприятный исход, более 20 баллов — неблагоприятный исход.
Для оценки степени функциональных исходов использовали шкалу Рэнкина. Оценка 0 баллов интерпретировалась как отсутствие симптомов, 1 степень — незначительное уменьшение дееспособности, 2 степень — лёгкая потеря дееспособности, 3 степень — средняя степень потери дееспособности, 4 степень — среднетяжёлая степень нарушения дееспособности, 5 степень — тяжёлое нарушение дееспособности. Шкала Ривермид использовалась для оценки степени мобильности пациента от 0 баллов (невозможность самостоятельного выполнения каких-либо произвольных движений) до 15 баллов (возможность пробежать 10 метров).
Для восстановления двигательного дефицита в группе обследуемых был применен реабилитационный комплекс Andago для восстановления навыков ходьбы (мануальной локомоторной терапии), состоящий из системы разгрузки веса пациента Lokobasis, беговой дорожки Woodway S55 с изменяемой скоростью движения, параллельных брусьев, регулируемых по ширине и высоте. Тренировки на комплексе проводились в среднем 4 раза в неделю. Количество тренировок варьировало от состояния пациента. Каждое занятие продолжалось в среднем 30 минут без учета времени, затраченного на подготовку пациента. Непосредственно перед началом тренировки оценивался исходный уровень пациента и, исходя из полученных значений, выставлялись параметры нагрузки. Вес пациента разгружался, начиная с 50 % и до 0 % в конце курса в зависимости от двигательных возможностей пациента. Проходимое пациентом расстояние и скорость ходьбы регулировались индивидуально с учетом критериев готовности к тренировкам и динамики локомоторной функции. Средняя скорость ходьбы составила 0,5—0,7 км/час. Дистанция, пройденная за одну тренировку, составила в среднем 100 метров.
Результаты исследования.
Проведён ретроспективный анализ результатов локомоторной терапии в остром периоде церебрального инсульта в группе пациентов (n=42), в том числе пациентов мужского пола — 25 (59,5 %), женского пола — 17 (40,5 %).
Исходная тяжесть инсульта по шкале NIHSS составила 10 баллов и менее — 16 случаев (38 %), 11—19 баллов — 22 случая (52 %), 20 баллов и более — 4 случая (10 %).
Исходная оценка по шкале Glasgow составила 15 баллов — 27 случаев (64 %), 10—14 баллов — 14 случаев (33 %), 9 и менее баллов — 1 случай (3 %).
Исходная оценка по шкале Рэнкин составила 0 баллов — 0 случаев (0 %), 1 балл — 0 случаев (0 %), 2 балла — 4 случая (10 %) , 3 балла — 5 случаев (12 %), 4 балла — 30 случаев (71 %), 5 баллов — 3 случая (7 %).
Исходная оценка по шкале Ривермид составила 0—5 баллов — 40 случаев (95 %), 6—10 баллов — 1 случай (2,5 %), 11 баллов и более — 1 случай (2,5 %).
После курса локомоторной терапии количество пациентов с оценкой по шкале NIHSS от 0 до 10 баллов: 32 случая (76 %), от 11 до 19 баллов — 10 случаев (24 %), 20 баллов и более — 0 случаев (0 %). Минимальное количество баллов при выписке составило 0 баллов, максимальное — 16 баллов (рис. 1).
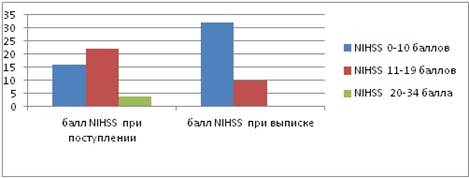
Рисунок 1. Количество пациентов по шкале NIHSS
Количество пациентов с оценкой по шкале Рэнкин при выписке составило: 0 баллов — 0 случаев (0 %), 1 балл — 1 случай (2 %), 2 балла — 9 случаев (21 %), 3 балла — 14 случаев (33 %), 4 балла — 18 случаев (43 %), 5 баллов — 0 случаев (0 %) (рис. 2).
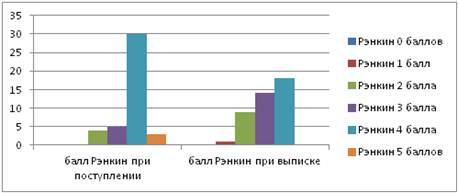
Рисунок 2. Количество пациентов по шкале Рэнкин
Количество пациентов с оценкой по шкале Ривермид от 0 до 5 баллов — 21 случай (50 %), от 6 до 10 баллов — 17 случаев (40 %), от 11 до 15 баллов — 4 случая (10 %) (рис. 3).
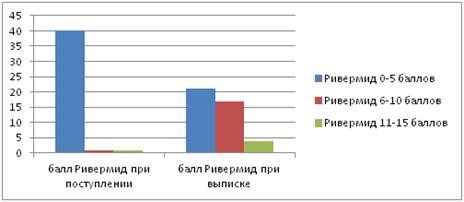
Рисунок 3. Количество пациентов по шкале Ривермид
Количество пациентов с оценкой по шкале Glasgow от 1 до 9 баллов — 0 случаев (0 %), от 10 до 14 баллов — 3 случая (7 %), 15 баллов — 39 случаев (93 %) (рис. 4).
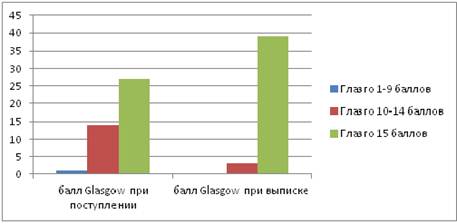
Рисунок 4. Количество пациентов по шкале Glasgow
Таким образом, количество пациентов с удовлетворительным исходом после курса локомоторной терапии возросло в сравнении с исходными данными. Если доля пациентов с умеренной симптоматикой (NIHSS 0—10 баллов) по исходным данным в общей группе составила 38 % (n=16), то после лечения их доля составила 76 % (n=32). Доля пациентов с тяжелыми функциональными расстройствами до лечения составила 7 % (n=3), после лечения данный показатель уменьшился и составил 0 % (n=0). Индекс мобильности Ривермид, напротив, возрос. Доля пациентов со значительными двигательными расстройствами (0—5 баллов) до лечения составила 95 % (n=40), после — 50 % (n=21), а доля пациентов с минимальными двигательными ограничениями (11—15 баллов) до лечения составила 2,5 % (n=1), после окончания лечения составила 10 % (n=4).
Выводы.
По окончании курса локомоторной тренировки в остром периоде церебрального инсульта было отмечено существенное улучшение двигательной активности пациентов. В обследуемой группе возросла доля пациентов с незначительной и умеренной неврологической симптоматикой, улучшились показатели мобильности пациентов, а доля пациентов с выраженным неврологическим дефицитом уменьшилась.
Таким образом, интенсивная локомоторная тренировка является эффективным методом восстановления двигательных функций, позволяет активизировать пациентов даже с выраженными двигательными нарушениями. Роботизированные устройства должны занимать важное место в комплексной реабилитации неврологических больных, требуются дальнейшие исследования как по изучению эффектов роботизированной реабилитации, так и по разработке новых роботизированных систем.
Список литературы:
1. Chugunova S.A., Nikolaeva T. Ya. The ethnic differences of stroke in Yakutia // International Journal of Circumpolar Health. 2013. Vol. 72, supplement 1, P. 321—324.
2. Chen S.Y., Winstein C.J. A systematic review of voluntary arm recovery in hemiparetic stroke: clincial predictors for meaningful outcomes using the international classification of functioning, disability, and health // J. Neurol. Phys. Ther. 2009. Vol. 33. P. 2—13.
3. Hinkle J.L. Variables explaining functional recovery following motor stroke // J. Neurosci Nurs. 2006. Vol. 38(1). P. 6—12.
4. Luft A.R., Hafer-Macko C., Schallert T. Physiological basis of rehabilitation therapeutics in stroke // Stroke recovery and rehabilitation / edited by Stein J., Harvey R.L., Macko R.F., Winstein C.J., Zorowitz R.D. New York, USA: Demos Medical Publishing. 2009. P. 145—152.
5. Miyai I., Yagura H., Oda I. et al. Premotor cortex is involved in restoration of gait in stroke // Ann Neurol. 2002. Vol. 52(2): P. 188—194.





