Особенности агрегации наночастиц TiO2 в нейтральных аминокислотах
Журнал: Научный журнал «Студенческий форум» выпуск №39(90)
Рубрика: Химия

Научный журнал «Студенческий форум» выпуск №39(90)
Особенности агрегации наночастиц TiO2 в нейтральных аминокислотах
Работы выполнены при поддержке гранта РФФИ № 18-33-00438.
Введение
С развитием нанотехнологий, с одной стороны, наночастицы диоксида титана (TiO2) могут сыграть большую роль в развитии раковой терапии [4], антибактериальной обработки поверхностных вод [5] и борьбы с бактериальными заболеваниями [3]. С другой стороны, благодаря малому размеру и высокой фотокаталитической активности наночастиц TiO2 характеризуются повышенной in vivo [1] и in vitro [6] токсичностью. Поэтому для биомедицинского применения наночастиц TiO2 необходимо изучать их взаимодействие с клеточными компонентами, включая протеины и аминокислоты [2]. Не смотря на высокую актуальность, до сих пор не достаточно данных о взаимодействии наночастиц TiO2 при с аминокислотами в разных кислотно-основных условиях. Поэтому целью настоящей работы являлось оценить влияние рН и размера наночастиц TiO2 на дисперсионные и электрокинетические свойства наночастиц в растворах низкомолекулярных алифатических аминокислот.
Материалы и методики
В работе исследовали наночастицы TiO2 со средним размером 30 нм (TiO2-30, PlasmaChem GmbH, Germany) и 140 нм (TiO2-140, Plasmatherm, Russia). Размер частиц был рассчитан из значений удельной площади поверхности (метод БЭТ, Сорби-М, 10,05 и 46,02 м2/г, соответственно, для TiO2-30 и TiO2-140). Согласно данным рентгенофазового анализа (XRD-7000, Shimadzu) порошки представляли собой смесь рутила и анатаза.
В качестве аминокислот использовали глицин (Gly, NH2-CH2-COOH) и цистеин (Cys, HОOC-CH(NH2)-CH2-SH). Обе аминокислоты являются нейтральными аминокислотами, при растворении не образующими заряженные частицы (неионогенными поверхностно-активными веществами).
Наночастицы выдерживали в водных суспензиях аминокислот с молярным содержанием «наночастицы : аминокислота = 1:1» при pH=3...9 (титрование 0,1 М NaOH и HNO3) в течение 24 ч с периодической УЗ обработкой.
Дисперсионные (средний размер агрегатов, dcр) и электрокинетические (ζ-потенциал) свойства наночастиц исследовали с помощью метода динамического рассеяния света с помощью анализатора Zetasizer Nano (Malvern, США, He-Ne-лазер, мощность 4 мВт, длина волны 633 нм) при 25°C. Степень агрегации (α) оценивали, как число частиц со средним размером в агрегате со средним размером, определенным из распределения частиц по размерам.
Результаты и их обсуждение
Согласно полученным данным кислотность среды оказывает неоднозначное влияние на агрегацию исследуемых частиц, которое больше зависит от природы аминокислоты и от размера частиц.
В целом, очевидно, что в глицине рН не оказывает большого влияния на свойства крупных частиц (рис.1): при рН 3…5…7…11 степень агрегации TiO2-140 колеблется незначительно и составляет, соответственно, 3,7…2,7…2,9…3,7. В то время, как для TiO2-30 – агрегация усиливается в области рН=5: так, в ряду рН 3…5…7…9…11 α составляет, соответственно 4,5…19,3…17,3…7,7…14,8.
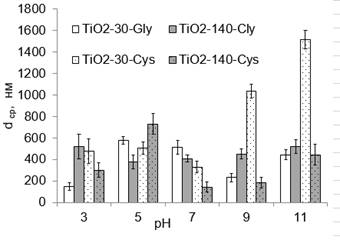
Рисунок 1. Влияние рН на средний размер агрегатов (dcр, нм) в суспензии
Следует отметить, что независимо от аминокислоты для обоих порошков при рН≤7 наблюдается наиболее интенсивная агрегация при рН=5. Такое поведение может быть связано с низкой электрокинетической стабильностью приготовленных суспензий. Согласно данным динамического рассеяния света при рН=3 все исследуемые частицы заряжены положительно (x-потенциал составляет 26…40 мВ), а при рН=5 – отрицательно (-17…-22 мВ, рис.2). Из этого следует, что точка нулевого заряда для частиц TiO2 находится вблизи рН=5, что объясняет образование крупных агрегатов в исследуемых суспензиях.

Рисунок 2. Влияние рН на x-потенциал частиц (мВ) в суспензии
Важно отметить, что независимо от выбранных условий и размера частиц характер изменения заряда поверхности не меняется. Несмотря на то, что при увеличении рН от 3 до 5 происходит резкое изменение знака заряда, в области рН=5…9 заряд практически не меняется, а при достижении сильно основной среды заряд немного уменьшается. Например, x-потенциал при рН 5…7…9…11 составляет -17…-18…-18…-28 мВ для TiO2-30 в глицине (рис.2). Аналогичные тенденции наблюдается для всех других экспериментов.
Сравнение степени дисперсности частиц разного размера показало, что практически при всех условиях эксперимента частицы с размером 30 нм подвергаются более интенсивной агрегации. Даже когда размер агрегатов крупного порошка больше, степень дисперсности меньше. Например, при рН=3 в Gly dcр составляет 147 и 521 нм, соответственно для TiO2-30 и TiO2-140 (рис.1), а степень дисперсности – 4,9 и 3,7, это разница в свойствах усиливается в цистеине при более высоких рН: например, при рН=7 dcр составляет 330 и 144 нм (рис.1), а α – 11 и 1,0, соответственно для TiO2-30 и TiO2-140.
При всех выбранных условиях за исключением рН=5 показано, что с уменьшением размера частиц агрегация TiO2 в цистеине – усиливается, а в глицине – ослабляется. Например, при рН=9 величина dcр, соответственно для TiO2-140 и TiO2-30, в цистеине составляет 184 и 1038 нм в цистеине (рис.1) – 452 и 232 и нм – в глицине (рис.2). На примере цистеина видно, что разница в степени агрегации частиц разного размера усиливается при добавлении ОН—ионов: так, при рН 3…7…9 степень агрегации крупных частиц уменьшается в 8…11…27 раз, а в Gly – степень агрегации увеличивается в 1…2…4 раз, соответственно, при рН=3…7…11.
Сравнение электрокинетических свойств показало, что в сильно кислой и сильно основной средах крупные частицы имеют более положительный заряд в глицине по сравнению с цистеином: например, x-потенциал TiO2-30 при рН=3 в Gly и Cys равен, соответственно, +39 и +26 мВ (рис.2)
Заключение
Таким образом, в работе на примере наночастиц TiO2 со средним размером 30 и 140 нм (метод БЭТ) показано образование неустойчивых суспензий в области рН=5 в растворах нейтральных аминокислот. При в интервале рН=3…5 происходит резкое изменение знака заряда с «+» на «-», а при рН=5…9 заряд практически не меняется. Продемонстрировано, что с уменьшением размера частиц агрегация TiO2 в цистеине – усиливается, а в глицине – ослабляется. Также показано, что в цистеине для TiO2-30 при рН=7…9 образуются крупные агрегаты, в которых находится 34…51 наночастиц.
Список литературы:

