ОПРЕДЕЛЕНИЕ ГЛУТАТИОНА В ЦИАНОБАКТЕРИЯХ МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ
Секция: 1. Химические науки

III Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ОПРЕДЕЛЕНИЕ ГЛУТАТИОНА В ЦИАНОБАКТЕРИЯХ МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ
Целью работы была апробация и корректировка методики определения глутатиона на приборе марки «Экотест-ВА» с датчиком «Модуль ЕМ-04» и последующим подбором условий для определения с её помощью количества глутатиона в клетках цианобактерий.
Объектом исследования стала методика определения глутатиона.
Методы исследования. За основу взята методика, разработанная для инверсионного вольтамперметра (ИВА) марки ТА-2 (г. Томск) с ртутно-плёночным электродом. Принцип анализа по этой методике заключается в том, что молекулы глутатиона образуют комплексные соединения с ионами ртути двухвалентной, образованные соединения прикрепляются к ртутной пленке на электроде за счет как раз иона двухвалентной ртути. При подаче напряжения происходит окисление глутатиона и прибор регистрирует катодный ток. Обязательным условием является наличие иона комплексообразователя для глутатиона (Hg2+, Cu2+, Zn2+ и т. д.), так как молекула глутатиона сама по себе электрохимически неактивна [4; 6].
Работу проводили на базе экоаналитической лаборатории ВятГГУ, использовали ИВА марки «Экотест-ВА» с датчиком «Модуль ЕМ-04». В комплект к прибору входит углеситалловый электрод, слой металлической ртути на поверхность электрода наносится электрохимически из раствора, содержащего нитрат ртути (II), в этот же раствор вводится добавка глутатиона известной концентрации. Условия проведения анализа частично взяты из методики для определения глутатиона на приборе марки ТА-2, это интервал потенциалов в котором будет проходить определение глутатиона — от 0 мВ до -800 мВ. Остальные необходимые параметры подбирали экспериментально, в соответствии со спецификой имеющегося анализатора: время накопления 300 сек, напряжение накопления 50 мВ, время очистки 0 сек. Катодный пик регистрировали в диапазоне потенциалов от -150 мB до -300 мB. Наблюдали линейную зависимость площади пика на вольтамперограмме от концентрации глутатиона в растворе (рис. 1).
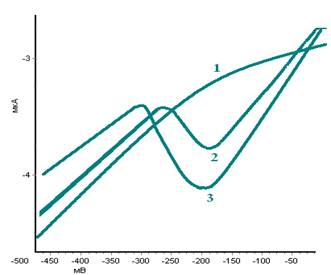
Рисунок 1. Вид вольтамперограмм в зависимости от концентрации глутатиона в растворе: 1 — фон; 2 — 4•10-6 моль/л; 3 — 16•10-6 моль/л
После отработки методики на ИВА, было исследовано содержание глутатиона в суспензии ЦБ Nostoc linckia 273 из коллекции фототрофных микроорганизмов кафедры ботаники, физиологии растений и микробиологии Вятской государственной сельскохозяйственной академии.
Для определения содержания глутатиона в микроорганизмах была подобрана методика, включающая следующие операции: 10 см3 суспензии растирают в ступке до получения гомогената, переносят в колбу на 50 см3, добавляют 10—15 см3 боратного буферного раствора pH 9,18 и нагревают на водяной бане при температуре 45—50° C в течение 10 минут. После этого раствор фильтруют через бумажный фильтр, который промывают буфером два раза по 5 см3. Затем 0,5 см3 переносят в стеклоуглеродный стаканчик (электрохимическую ячейку), прибавляют 5 см3 фонового раствора нитрата ртути (II), 15 мл боратного буфера и доводят объем до 25 см3 дистиллированной водой.
Предложенный способ количественного определения глутатиона отличается простотой, не требует больших трудозатрат, значительного количества реактивов и отличается высокой экспрессностью и чувствительностью.
Известно, что во многих методиках, основанных на получении данных о содержании искомого компонента по калибровочным зависимостям, существует погрешность, связанная с разницей условий при построении калибровочной зависимости и реальными условиями исследования пробы. В пробе могут быть компоненты, о которых даже не догадывается исследователь, и которые могут существенно исказить результат. В суспензии ЦБ много соединений, которые могут вступать в реакцию с ртутью и возможно искажать результат. Поэтому в методику для количественного определения глутатиона в ЦБ нами была введена операция расчета по градуировочному уравнению [5]. Согласно этой методике, надо снять вольтамперограммы с трёх растворов: исследуемая проба, исследуемая проба с добавкой и разбавленная в два раза исследуемая проба с добавкой. Далее рассчитать концентрацию искомого компонента по градуировочному уравнению:
![]() ,
,
где: х — исходная концентрация в пробе, мкг/дм3;
∆С — известная добавка, мкг/дм3;
у1 — площадь пика исходной пробы;
у2 — площадь пика исходной пробы с добавкой;
у3 — площадь пика исходной пробы с добавкой, разбавленная в два раза.
В результате определения содержания глутатиона в суспензии цианобактерий, согласно стандартной методике и расчету результата в программном обеспечении компьютера содержание получилось 0,70±0,08 ммоль/дм3, а по способу с применением градуировочного уравнения 0,88±0,11 ммоль/дм3. Оба результата находятся относительно друг друга в пределах погрешности.
Далее исследовали содержание восстановленных форм глутатиона в суспензии культуры ЦБ Nostoc linckia 273 после воздействия на микроорганизмы ионов меди. Культуру ЦБ вносили в раствор сульфата меди (II), с концентрацией ионов меди (II) 2 и 20 мг/дм3 (титр культуры составил 4,7∙108 кл/мл). Культуру выдерживали в растворах в течение одних и 15 суток.
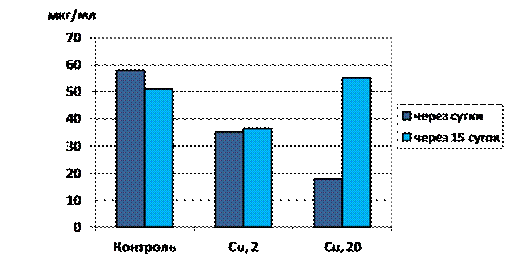
Рисунок 2. Влияние сульфата меди (II) на содержание глутатиона в суспензии цианобактерий
Через сутки наблюдали зависимость: чем выше концентрация ионов меди в растворе, тем меньше удается обнаружить восстановленных форм глутатиона. Это логично, так как он идет на связывание меди. Чем выше концентрация меди, тем больше его идет на связывание, тем меньше остается свободного. Через 15 суток картина меняется. В варианте с самым высоким содержанием меди обнаружено увеличение концентрации восстановленного глутатиона. Это объясняется работой защитных механизмов культуры, проявляющихся в активном синтезе глутатиона в ответ на действие токсиканта, который для культуры необходим как антиоксидант при возникшем стрессе и детоксикатор ионов меди.
Таким образом, в результате проведения серии экспериментов, была адаптирована методика количественного определения глутатиона к ИВА марки «Экотест-ВА» с углеситалловым электродом и откорректированы условия успешного определения содержания пептида в суспензии ЦБ. Методика пригодна для применения в дальнейших экспериментах.
Список литературы:
- Будников Г.К. Электрохимическое определение глутатиона / Г.К. Будников, Г.К. Зиятдинова, Я.Р. Валитова // Журнал аналитической химии. — 2004. — Т. 59. — № 6. — С. 645—648.
- Внутренний контроль качества результатов количественного химического анализа. (РМГ 76-2004). М.: Стандартинформ, 2006.
- Дорожко Е.В. Исследование электрохимических свойств глутатиона методом вольтамперометрии / Е.В. Дорожко, Е.И. Короткова // Химия и химическая технология — 2010. — том 53. — С. 35—38.
- Короткова Е.И. Способ определения глутатиона в биологически активных добавках методом катодной вольтамперометрии / Е.И. Короткова, Е.В. Дорожко: Патент RU 2441225 C1. Заявка: 2010141687/28, 12.10.2010. Дата начала отсчета срока действия патента: 12.10.2010.
- Некрасова Г.Ф., Некрасова О.А. Оценка основных сред обитания живых организмов. Учеб. пособие. — Екатеринбург: Изд-во Урал. ун-та, 2007. — С. 19—23.
- Ellman G.L. Tissue sulfhydryl groups // Arch. Biochem. Biophys. — 1959. — Vol. 82. — P. 70—81.





