ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ КЛИК-РЕАКЦИИ АЗИД-АЛКИНОВОГО ЦИКЛОПРИСОЕДИНЕНИЯ В ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ
Секция: 1. Химические науки

VI Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ КЛИК-РЕАКЦИИ АЗИД-АЛКИНОВОГО ЦИКЛОПРИСОЕДИНЕНИЯ В ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ
На сегодняшний день фармацевтическая промышленность испытывает недостаток в новых лекарственных препаратах. По данным исследований, в самом начале XXI века количество новых внедренных лекарств существенно снизилось. Если еще в 1990-х за год получали порядка 50 новых соединений, то в 2000 году было синтезировано всего 27 новых медикаментов. В 2001 году цифра упала до 24, а в 2002 году было получено лишь 18 новых препаратов [5]. Снижение количества медицинских средств объясняется многими факторами. Так, одной из наиболее главных причин являются уже достигнутые достаточно высокие терапевтические стандарты, и поэтому основная часть исследований сводится к поиску лекарств для хронических дегенеративных и других смертельных заболеваний [14]. К тому же, требования к эффективности и безопасности новых лекарственных средств стремительно возрастают [3].
Значительный прогресс в разработке новых химических веществ связан с реакцией азид-алкинового циклоприсоединения.
Первое сообщение о взаимодействии азидов и алкинов с образованием 1,2,3-триазолов было опубликовано еще в 1893 году химиком Артуром Михаэлем. Выдерживая на свету или нагревая эфирный раствор фенилазида и диметилового эфира ацетиледикарбоновой кислоты, он получил соответствующий триазол [10]:
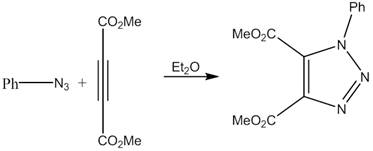
В начале 1960-х Рольф Хьюсген разработал общую концепцию 1,3-диполярного циклоприсоединения и исследовал некаталитический вариант реакции азидов с алкинами, продуктом которой являлась зачастую трудноразделимая смесь двух изомерных триазолов. Их соотношение зависело от типов заместителей в реагентах, однако добиться получения одного изомера было невозможно [6]. В 2002 году группами Мортена Мельдаля и Барри Шарплесса с Валерием Фокиным независимо друг от друга было обнаружено, что при применении соединений одновалентной меди как катализаторов реакция приводит к образованию исключительно 1,4-дизамещенных 1,2,3-триазолов [4]. Шарплесс и Фокин описали эту реакцию как «новый каталитический процесс, предполагающий беспрецедентный уровень селективности, надежности и применимости для того органического синтеза, при котором необходимо создать ковалентные связи между разнообразными строительными блоками» [13]. Все химические реакции, приспособленные для того, чтобы путем соединения отдельных маленьких элементов быстро и надежно получить новое химическое вещество, Шарплесс обобщил одним понятием — «клик-химия» [7].
В то время как термическое 1,3-диполярное циклоприсоединение Хьюсгена является синхронным процессом, реакция с участием одновалентной меди протекает ступенчато: сначала образуется ацетеленид меди из алкина и катализатора, затем присоединяется азид и происходит циклизация образующегося интермедиата с последующим сужением цикла, образованием медного производного триазола и гидролизом связи медь-углерод [12].
Ввиду того, что для такого пути реакции энергия интермедиатов значительно снижена, общая скорость превращения увеличивается в 107 раз по сравнению с согласованным процессом [17].
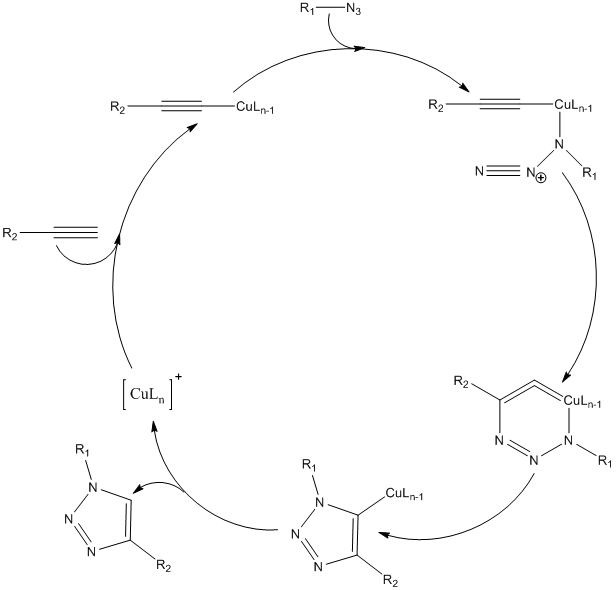
Рисунок 1. Механизм Cu(I)-катализируемого циклоприсоединения азидов и алкинов. L — одновалентные лиганды.
Кинетика азид-алкинового циклоприсоединения была изучена в отсутствие одновалентных лигандов, а катализатор Cu(I) был получен непосредственно из CuSO4 и аскорбата натрия, система которых является наиболее часто используемой для этой реакции в водной среде [12].
Аскорбат натрия можно получить при взаимодействии аскорбиновой кислоты и пищевой соды:

После ряда проведенных опытов было замечено, что в ходе клик-реакции необходимо использовать избыток аскорбата натрия. По мере протекания реакции восстановитель, как соль слабой кислоты, выступает в роли буфера для связывания кислотности, смещая равновесие в сторону образования Cu2O:
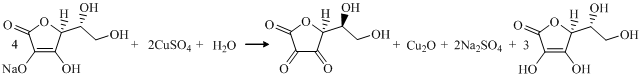
Кроме того, что соль аскорбиновой кислоты нужна для образования оксида меди(I) из сульфата, она также делает систему катализаторов менее восприимчивой к O2. Оксид одновалентной меди очень чувствителен к окислению кислородом воздуха, а избыток аскорбата натрия, не давая ему перейти в соединение Cu(II), поддерживает необходимую и достаточную концентрацию Cu(I). Пребывающие в растворе наночастицы оксида в значительной мере защищены от окисления за счет того, что преимущественно окисляется аскорбат. К тому же избыток соли аскобиновой кислоты используют для создания бескислородной среды.
Помимо азид-алкинового циклоприсоединения, в которых роль катализатора выполняет одновалентная медь, были изучены и предложены реакции, катализируемые комплексами рутения [19] и P,O-комплексами серебра(I) [9], однако они не получили такого же широкого применения.
В 2004 году группой Каролин Бертоцци было разработано безмедное азид-алкиновое циклоприсоединение. Классическая реакция азида с алкинами под действием одновалентной меди является очень быстрой и эффективной, однако она не может быть использована в живых клетках из-за токсичности ионов Cu+. В то время как реакция, разработанная Бертоцци, является биортогональной, то есть протекает в биологических системах без нарушения их естественных процессов [1].
С помощью реакции азид-алкинового циклоприсоединения из компонентов нуклеиновых кислот были получены терапевтические агенты — триазолсодержащие нуклеозиды. Эти соединения проявляют высокую антибактериальную и противовирусную активность. Так, например, были синтезированы вещества, обладающие активностью в отношении вирусов коровьей оспы и табачной мозаики [2; 8; 11; 18].
Помимо этого рассматриваются и потенциальные терапевтические агенты бор-нейтронзахватной терапии рака — нуклеозиды, присоединенные клик-лигированием к карборанам и металлокарборанам [16]. А 2006 году Валерий Фокин и Джон Элдер методами клик-химии получили новый ингибитор протеазы ВИЧ-1 [15]:
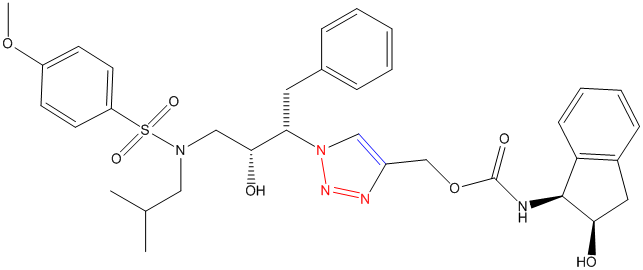 Рисунок 2. Структурная формула [1-[(1S,2S)-1-бензил-2-гидрокси-3-[изобутил-(4-метоксифенил) сульфониламино]пропил]триазол-4-ил]метил-N-[(1S,2R)-2-гидроксииндан-1-ил]карбамата
Рисунок 2. Структурная формула [1-[(1S,2S)-1-бензил-2-гидрокси-3-[изобутил-(4-метоксифенил) сульфониламино]пропил]триазол-4-ил]метил-N-[(1S,2R)-2-гидроксииндан-1-ил]карбамата
Таким образом, реакция азид-алкинового циклоприсоединения на сегодняшний день оказывает значительное и растущее влияние на фармацевтическую промышленность. Приведенные примеры отчетливо показывают, что клик-химия становится очень важной областью изучения во многих науках, включая и химию лекарственных соединений.
Список литературы:
- Agard N.J., Prescher J.A., Bertozzi C.R. A Strain-Promoted [3 + 2] Azide-Alkyne Cycloaddition for Covalent Modification of Biomolecules in Living Systems. J. Am. Chem. Soc., 2004, v. 126, — p. 15046-15047.
- Cho J.H., et al. Synthesis of Cyclopentenyl Carbocyclic Nucleosides as Potential Antiviral Agents Against Orthopoxviruses and SARS. J. Med. Chem., 2006, v. 49, — p. 1140—1148.
- Drews J. Strategic trends in the drug industry. Drug Discov. Today, 2003, v. 8, — p. 411—420.
- Dijk, van M., Rijkers D.T., Liskamp R.M., Nostrum van C. F., Hennink W.E. Synthesis and Applications of Biomedical and Pharmaceutical Polymers via Click Chemistry Methodologies. Bioconjugate Chem., 2009, v. 20, — p. 2001—2016.
- Frantz S., Smith A. New drug approvals for 2002. Nature Rev. Drug Discov. Today, 2003, v. 2, — p. 95—96.
- Huisgen R. Kinetics and Mechanism of 1,3-Dipolar Cycloadditions. Angew. Chem. Int. Ed., 1963, v. 2, — p. 633—645.
- Kolb H.C., Finn M.G., Sharpless K.B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed., 2001, v. 40, — p. 2004—2021.
- Li W., et al. Bitriazolyl acyclonucleosides with antiviral activity against tobacco mosaic virus. Tetr. Letters, 2008, v. 49, — p. 2804—2809.
- McNulty J., Keskar K., Vemula R. The First Well-Defined Silver(I)-Complex-Catalyzed Cycloaddition of Azides onto Terminal Alkynes at Room Temperature. Chem. Eur. J., 2011, v. 17, — p. 14727—14730.
- Michael A. Ueber die Einwirkung von Diazobenzolimid auf Acetylendicarbonsäuremethylester. J. Prakt. Chem, 1893, v. 48, — p. 94—95
- Perez-Castro I., et al. Synthesis of 4-substituted-1,2,3-triazole carbanucleoside analogues of ribavirin via click chemistry. Org. Biomol. Chem., 2007, v. 5, — p. 3805—3813.
- Rodionov V.O., Fokin V.V., Finn M.G. Mechanism of the Ligand‐Free CuI‐Catalyzed Azide-Alkyne Cycloaddition Reaction. Angew. Chem., 2005, v. 44, — p. 2210—2215.
- Rostovtsev V.V., Green L.G., Fokin V.V., Sharpless K.B. A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective “Ligation” of Azides and Terminal Alkynes. Angew. Chem. Int. Ed., 2002, v. 41, — p. 2596—2599.
- Spilker B. The seven(teen) deadly sins in pharmaceutical companies. Drug. News Perspect, 1997, v. 10, — p. 203—207
- Whiting M., Muldoon J., Lin Y.C., Silverman S.M., Lindstrom W., Olson A.J., Kolb H.C., Finn M.G., Sharpless K.B., Elder J.H., Fokin V.V. Inhibitors of HIV-1 protease by using in situ click chemistry. Angew. Chem. Int. Ed., 2006, v. 45, — p. 1435—1439.
- Wojtczak B. A., et al. “Chemical Ligation”: A Versatile Method for Nucleoside Modification with Boron Clusters. Chem. Eur. J., 2008, v. 14, — p. 10675—10682.
- Wu P., Fokin V.V. Catalytic Azide-Alkyne Cycloaddition: Reactivity and Application. Aldrichimica Acta, 2007, v. 40, — p. 7—17.
- Xia Y., et al. Synthesis of bitriazolyl nucleosides and unexpectedly different reactivity of azidotriazole nucleoside isomers in the Huisgen reaction. Org. Biomol. Chem., 2007, v. 5, — p. 1695—1701.
- Zhang L, Chen X., Xue P., Sun H.H.Y., Williams I.D., Sharpless K.B., Fokin V.V., Jia G. Ruthenium-Catalyzed Cycloaddition of Alkynes and Organic Azides. J. Am. Chem. Soc., 2005, v. 127, — p. 15998—15999.





