ЖЕСТКОСТЬ ВОДЫ И ЕЕ ВЛИЯНИЕ НА ЖИВЫЕ ОРГАНИЗМЫ
Секция: 1. Химические науки

VIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ЖЕСТКОСТЬ ВОДЫ И ЕЕ ВЛИЯНИЕ НА ЖИВЫЕ ОРГАНИЗМЫ
В связи с тем, что вода является хорошим растворителем можно сказать, что в природе нет совершенно чистой воды, хотя бы потому что растворяет на своем пути многие соединения и вещества, становясь сразу же смесью многих растворенных веществ. Образовавшаяся смесь содержит многие ионы, в частности ионы кальция и магния, которые обуславливают жесткость воды. Причем чем больше ионов кальция и магния, тем жестче вода.
В большей степени жесткость воды связана с катионами кальция (Са2+) и в меньшей степени магния (Mg2+). Все двухвалентные катионы влияют на жесткость воды, так как они, взаимодействуя с анионами, образуют соединения, выпадающие в осадок. Одновалентные катионы таким свойством не обладают.
В таблице 1 приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они объединяются, образуя соответствующие соединения.
Таблица 1.
Катионы, анионы и соединения, обуславливающие жесткость воды
Катионы |
Анионы |
Соединения |
Кальций (Ca2+) |
Гидрокарбонат (HCO3-) |
Ca(HCO3)2 |
Магний (Mg2+) |
Сульфат (SO42-) |
MgSO4 |
Стронций (Sr2+) |
Хлорид (Cl-) |
SrCl2 |
Железо (Fe2+) |
Нитрат (NO3-) |
Fe(NO3)2 |
Марганец (Mn2+) |
Силикат (SiO32-) |
MnSiO3 |
Из-за ничтожно малого оказания влияния на жесткость воды наличием в ней стронция, железа и марганца пренебрегают.
Малая растворимость в природных водах алюминия и трехвалентного железа вносит очень малый «вклад» в жесткость воды, которым так же пренебрегают.
Влияние ионов бария не учитывается из-за незначительного их нахождения в воде.
Различают следующие виды жесткости:
· общая жесткость (карбонатная — временная или устранимая) — обусловленная концентрацией гидрокарбонатов (и карбонатов при рН > 8.3) солей кальция и магния;
· некарбонатная — обусловленная концентрацией в воде кальциевых и магниевых солей сильных кислот.
· Жесткость устраняется несколькими способами:
· карбонатную — простым кипячением, так как при этом карбонаты и гидрокарбонаты кальция и магния выпадают в осадок;
Ca(HCO3)2 → CaCO3↓ + CO2↑+ H2O
· - некарбонатную — можно умягчить, обрабатывая воду гашеной известью или содой. Она не устраняется кипячением. Так как такая жесткость не дает осадков, и не испаряется при кипячении.
CaSO4 + Na2CO3 →CaCO3↓ + Na2SO4
Ca(HCO3)2 + Ca(OH)2 → CaCO3↓ + H2O
MgSO4 + Ca(OH)2 → Mg(OH)2↓ + CaSO4↓
Для устранения ионов кальция и магния можно использовать фосфат натрия, буру, поташ и другие химические соединения:
CaSO4 + K2CO3 → CaCO3↓ + K2SO4
MgSO4 + Na2B4O7*10H2O → MgB4O7↓ + Na2SO4
CaSO4 + Na3PO4 → Ca3(PO4)2↓ + Na2SO4
Сумма карбонатной и некарбонатной жесткости определяет общую жесткость воды. Показатель жесткости воды не постоянен.
В мировой практике приняты единицы измерения жесткости, которые определенным образом соотносятся друг с другом (табл. 2).
Таблица 2.
Единицы жесткости воды
Российский; моль/м3(мг*экв/л) |
Немецкий градус; do |
Французский градус; fo |
Американский градус; ppm (мг/дм3) СаСО3 |
1,000 |
2,804 |
5,005 |
50,050 |
Таблица наглядно иллюстрирует гораздо более «жесткий» подход к проблеме жесткости воды. В таблице 3 представлены значения жесткости воды.
Таблица 3.
Значения жесткости воды
Жесткость воды в мг-экв |
Справочник по Гидрохимии/10/ |
Водоподготовка/9/ |
Германия DIN 19643
|
USEPA |
0-1,5 |
Мягкая (0-4 мг-экв) |
Очень мягкая (0-1,5 мг-экв) |
Мягкая (0-1,6 мг-экв) |
Мягкая (0-1,5 мг-экв) |
1,5-1,6 |
Мягкая (1,5-3 мг-экв) |
Умеренно Жесткая (1,5-3 мг-экв) |
||
1,6-2,4 |
Средней жесткости (1,6-2,4 мг-экв) |
|||
2,4-3,0 |
Достаточно жесткая (2,4-3,6 мг-экв) |
|||
3,0-3,6 |
Умеренно жесткая (3-6 мг-экв) |
Жесткая (3-6 мг-экв) |
||
3,6-4,0 |
Жесткая (3,6-6 мг-экв) |
|||
4,0-6,0 |
Средней жесткости (4-8 мг-экв) |
|||
6,0-8,0 |
Жесткая (6-9 мг-экв) |
Очень жесткая (>6 мг-экв) |
Очень жесткая (>6 мг-экв) |
|
8,0-9,0 |
Жесткая (8-12 мг-экв) |
|||
9,0-12,0 |
Очень жесткая (>12 мг-экв) |
|||
>12,0 |
Очень жесткая (>12мг-экв) |
Из таблицы видно, что различные источники информации и ГОСТы разных стран по-разному измеряют жесткость воды:
· мягкая и очень мягкая лежит в диапазоне 0—4,0 мг-экв;
· умеренно жесткая, средней жесткости и достаточно жесткая располагается в диапазоне 1,5—8,0 мг-экв;
· жесткая и очень жесткая имеет значения 3,0—12,0 и более 12 мг-экв;
Жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океаническая вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Жесткая вода образует накипь при кипячении и в трубах отопительной системы, разрушая металл. В то же время она пагубно влияет и на организм человека, а так же растения. Она является очень важным фактором для гидропонного выращивания растений, потому что корни непосредственно находятся в рабочем растворе. Поэтому для успешного роста и развития растений, обязательно стоит контролировать жесткость.
Жёсткая вода и ее влияние на организм человека.
Вода, являясь жизненно необходимым продуктом и веществом для живого организма в целом и человека в частности, все же может оказывать пагубное влияние на организм человека:
· кожа человека при действии на нее жесткой воды преждевременно стареет;
· соли, обуславливающие жесткость воды, при взаимодействии с моющими средствами образуют некие «осадки» в виде пены, которые после высыхания образуют микроскопическую корочку на коже человека и волосах, которые разрушают естественную жировую пленку, защищающую нормальную кожу от старения и неблагоприятных климатических воздействий — все это забивает поры, вызывая сухость, шелушение и перхоть, в результате чего кожа не только рано стареет, но и становится аллергенной и чувствительной к раздражению;
· органы пищеварения подвергаются отрицательному действию в результате действия на них жесткой воды, соли которой, соединяясь с белками животного происхождения в нашей пище, оседают на стенки пищевода, желудка, кишечника тем самым мешают перистальтике, вызывают дисбактериоз, нарушают работу ферментов, отравляя организм — в связи, с чем употребление воды с повышенной жесткостью приводит к снижению моторики желудка и накоплению солей в организме;
· повышенное содержание ионов кальция и магния в воде пагубно влияют на сердечно — сосудистую систему, так как ионы Ca2+ контролируют ритм сердца и они необходимы для сокращения и релаксации, в том числе и сердечной мышцы;
· такие заболевания суставов как артрит и полиартрит вызываются постоянным употреблением внутрь воды с повышенной жесткостью, в результате чего попадающие с ней соли и ядовитые кристаллы образуют неорганические соединения, которые заменяют синовиальную жидкость (смазка) в местах подвижности костного скелета, что вызывает у человека болезненные ощущения;
· существует мнение, что жесткость воды приводит к образованию камней в почках и желчных путях, однако камни в почках образуются из-за недостатка кальция в пище. Было доказано, что почечные камни и костяные шпоры состоят, в том числе из ионов кальция, выщелачиваемого из костей для нейтрализации кислотности жидких сред организма. С другой стороны, ион Mg2+ является антагонистом иона Ca2+ в обменных процессах. При избытке ионов Mg2+ увеличивается выведение ионов Ca2+ из организма, то есть ион Mg2+ начинает вытеснять ион Ca2+ из тканей и костей, что ведёт к нарушению нормального костеобразования.
С целью сравнения известных данных по рН и жесткости воды были взяты пробы воды реки Белая на территории г. Бирск Республики Башкортостан в период октябрь — декабрь 2012 года и январь — декабрь 2013 года.
Анализ на рН и жесткость показал, что вода р. Белая находится в пределах допустимой нормы и особо пагубного влияния на здоровье человека и рост и развитие растений не оказывает. Результаты анализа воды представлены на рис. 1—2.
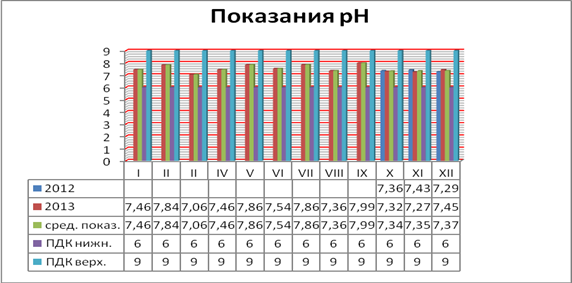
Рисунок 1. Показания рН воды реки Белая
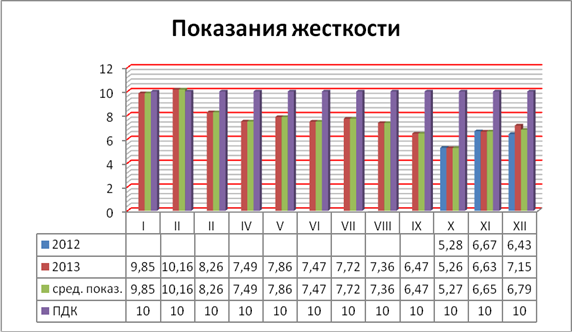
Рисунок 2. Показания жесткости воды реки Белая
Таким образом, жесткость воды это ее особое состояние. Она влияет на растения и на живой организм, но без жесткости воды нельзя. Так как нельзя употреблять чистейшую воду имеющий состав только водород и кислород.
Вода, используемая в работе, взята на территории г. Бирск. Жесткость этой воды находится в пределах ПДК, так как река Белая протекает в данной местности по равнине, где наличие известняков и доломитов ограничено.
В своих исследованиях при проведении эксперимента автор опирался на известные литературные данные [1; 2].
Список литературы:
1. Жесткая вода и ее влияние на организм человека. — [электронный ресурс] — Режим доступа. — URL: http://lib2.znate.ru/docs/index-347029.html (дата обращения 19.09.2013).
2. Развитие идей энергоресурсосбережения в образовательной системе — [электронный ресурс] — Режим доступа. — URL: http://kk.convdocs.org/docs/index-255646.html (дата обращения 29.03.2012).





