ИССЛЕДОВАНИЕ МУТАГЕННОГО ДЕЙСТВИЯ ИЗЛУЧЕНИЯ СОТОВЫХ ТЕЛЕФОНОВ НА ЖИВЫЕ ОРГАНИЗМЫ
Секция: 2. Биологические науки

X Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ИССЛЕДОВАНИЕ МУТАГЕННОГО ДЕЙСТВИЯ ИЗЛУЧЕНИЯ СОТОВЫХ ТЕЛЕФОНОВ НА ЖИВЫЕ ОРГАНИЗМЫ
Мобильная связь стала неотъемлемой частью нашей жизни. Сотовый телефон используется регулярно почти каждым человеком ввиду его необходимости в быту. Но не все знают, что это источник ультравысокочастотного излучения (УВЧ-излучения). УВЧ-излучение может являться не только причиной нарушения функций органов, но и вызывать генетические изменения в клетках — мутации [3; 4; 6; 7]. Мутации соматических клеток могут стать причиной онкологических, аутоагрессивных заболеваний, аллергий, преждевременного старения и т. д. Мутации в половых клетках передаются последующему поколению. Следствием этого могут быть различные наследственные заболевания, врожденные пороки развития. Накапливаясь и умножаясь, такие вредные мутации могут привести вид к вырождению и вымиранию [5]. Генный аппарат устроен сходным образом у всех эукариот, излучение может влиять на наследственность разных видов организмов от бактерий до человека сходным образом [6]. Поскольку УВЧ-излучение является одним из широко распространенных антропогенных загрязнений окружающей среды, его изучению посвящено достаточно много работ. Это одна из актуальных тем на стыке генетики и экологии. Однако результаты исследований получены противоречивые [4; 8]. Одной из причин этого является то, что исследования проводятся на разных объектах, регистрируются разные типы изменений. Поэтому необходимо проведение дополнительных исследований, и в особенности генетических [8]. Дело в том, что мутагены могут быть универсальными, т. е. вызывать генетические нарушения у всех организмов от вируса до человека, или специфическими — вызывать мутации только у определенных видов. Поэтому специфические мутагены могут быть не выявлены. Чтобы выяснить к какому типу относится УВЧ, необходимо изучить его действие на разные виды, особенно далеко отстоящие на эволюционной лестнице. Эффект УВЧ может быть различным при действии на соматические и половые клетки. Чтобы это выяснить, необходимо сравнить действие излучения на эти клетки.
В связи с вышесказанным целью данной работы является оценка мутагенного влияния сотового телефона на растительные и животные организмы. Для этого были поставлены следующие задачи:
· исследовать влияние активного излучения мобильного телефона на растительные клетки — корневую меристему лука Allium cepa L.;
· исследовать влияние активного излучения мобильного телефона на половые клетки плодовой мушки Drosophila melanogaster;
· сравнить мутагенное действие излучения сотового телефона на растительные и животные организмы.
Материалы и методы.
В качестве источника УВЧ-излучения был выбран мобильный телефон Sony Ericsson K550i Cyber shot. Фотоматериалы в ходе данных экспериментов были получены с использованием цифрового фотоаппарата Fujifilm FinePix J30.
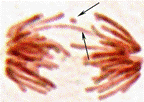
Allium cepa L. как тест-объект. Для оценки мутагенного действия излучения телефона использовались два теста: метод учета хромосомных аберраций (ХА) и микроядер (МЯ) в меристеме Allium cepa (Allium-test) и метод учета доминантных летальных мутаций (ДЛМ) у Drosophila melanogaster. Использование этих двух тестов позволяет регистрировать широкий круг генетических нарушений: генные, хромосомные и геномные мутации, мутации как в соматических, так и в половых клетках, мутации в растительном и животном организмах. Allium-test позволяет регистрировать хромосомные мутации в виде фрагментов и мостов, которые являются следствием грубых ХА типа делеций и транслокаций (рис. 1а, б), и МЯ, которые связаны с изменением поведения хромосом на веретене деления (рис. 2). Использовалась стандартная методика Allium-test в модификации В.Н. Калаева [3] и Д.С. Песни [4]. Модификация заключается в том, что для анализа генетических повреждений использовались одновременно микроядерный тест и ана-телофазный анализ, т. е. на одном препарате одновременно можно выявлять ХА, отставания хромосом и МЯ. Одновременное использование двух тестов на одном препарате позволяет анализировать всю совокупность клеток, следовательно, повышает разрешающую способность каждого метода и дает более достоверные результаты [3; 4].
Ана-телофазный метод учета хромосомных аберраций. Частота генетических повреждений определялась как отношение суммы мутантных клеток с мостами, фрагментами и отставаниями хромосом (отс.) в опытном варианте к общему количеству ана- и телофаз, выраженное в процентах:
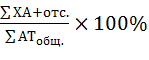
Микроядерный тест. В микроядерном тесте ведется идентификация и учет микроядер в интерфазных клетках к общей сумме интерфаз на препарате, выраженное в процентах:

Микроядра состоят главным образом из ацентрических фрагментов (рис. 2а), но могут быть образованы и целой хромосомой (рис. 2б), в результате нерасхождения, вызванного дефектом веретена деления. Также микроядра могут образовываться в результате деструкции интерфазного хроматина, то есть еще до деления клеток (рис. 2в). Необходимость в применении микроядерного теста обусловлена тем, что мутации, индуцированные в конкретный момент времени в делящихся клетках (в митозе), затем перейдут в интерфазы и поэтому не будут обнаружены ана-телофазным методом. Таким образом, микроядерный тест позволяет расширить диапазон изучаемых клеток, что делает метод еще более оперативным и экономичным [3; 4].
 а)
а)  б)
б)  в
в
Рисунок 1. Микропрепараты клеток лука с мутациями (окр. ацеторсеин; ув. 12,5×40): а-мост и фрагмент; б-тройной фрагмент; в-отставание
 а)
а)  б)
б) 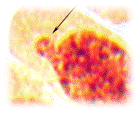 в)
в)
Рисунок 2. Микропрепараты клеток лука с мутациями (окр. ацеторсеин; ув. 12,5×40): а, б-микроядра; в-деструкция интерфазного хромат
Drosophila melanogaster как тест-объект. Drosophila melanogaster — классический объект изучения генетики. Около 75 % генов, ответственных за болезни у человека, обнаруживают гомологию в геноме дрозофилы. Стоит также отметить, что опыты на данном модельном объекте коррелируют с данными, полученными на млекопитающих [2].
Метод учета частоты доминантных летальных мутаций (ДЛМ). ДЛМ — мутации, приводящие к гибели развивающегося организма до выхода из яйца. Для постановки опыта использовалась линия дрозофилы дикого типа D-32, полученная на кафедре генетики МГУ им. Ломоносова. Метод учета частоты ДЛМ — один из самых простых и экономичных методов выявления мутагенного эффекта, как индивидуальных загрязнителей, так и суммарной мутагенной активности (СМА) окружающей среды. Доминантные летальные мутации, которые индуцируются мутациями в сперматозоидах, приводят к гибели зиготы или развивающегося эмбриона в результате хромосомных аберраций, или блокирования репликации ДНК [6]. ПЭЛ (поздние эмбриональные летали) и РЭЛ (ранние эмбриональные летали) — это два класса ДЛМ, которые определяются визуально. Яйца с ПЭЛ коричневого, палевого или желтого цвета (рис. 3г), а с РЭЛ — белого цвета, и внутри них видны остановившиеся этапы сегрегации эмбриона – белые непрозрачные уплотнения (рис. 3в). Подсчет ведется на стадии яйца, т. е. считается количество развившихся из яиц личинок (рис. 3а) (по оболочкам от яиц (рис. 3б)) и количество неразвившихся яиц. Также при воздействии на мух мутагенами имеется определенная вероятность откладки неоплодотворенных яиц (физиологические повреждения сперматозоидов или снижение половой активности самцов) (рис. 3в). Частота ДЛМ в процентах определялась по формуле:
 ,
,
![]()
![]() где частота ДЛМ (%) определялась как отношение общего числа отложенных яиц ( ) к числу яиц с ПЭЛ и РЭЛ ( ).
где частота ДЛМ (%) определялась как отношение общего числа отложенных яиц ( ) к числу яиц с ПЭЛ и РЭЛ ( ).
 а)
а) б)
б) в)
в) г)
г)
Рисунок 3. Drosophila melanogaster D32 (ув. 8×5×1,5): а-вылупившаяся личинка; б-пустая оболочка яйца, из которого вылупилась личинка; в-невылупившиеся яйца: слева неоплодотворённое, справа РЭЛ; г-ПЭЛ
Методика оценки уровня мутагенного эффекта. Для сравнения степени мутагенного эффекта, полученного в разных тестах, нами использован такой показатель как ВМЭ (выраженности мутагенного эффекта) [5]. ВМЭ определялась в Allium-test и в тесте ДЛМ у Drosophila melanogaster как кратность превышения процента индуцированных мутаций над контрольным значением. Для удобства восприятия цифровых данных баллы ВМЭ ранжированы по уровню мутагенного эффекта (табл. 1) [5].
Таблица 1.
Оценка выраженности мутагенного эффекта
Выраженность мутагенного эффекта |
Уровень мутагенного эффекта |
Отсутствие достоверных различий |
Отсутствие (0) |
Превышение контрольного |
Слабый (1) |
Превышение контрольного |
Средний (2) |
Превышение контрольного |
Сильный (3) |
Методы статистической обработки. Статистическую обработку результатов проводили с помощью программного пакета «Statistica». Определяли среднее арифметическое (X) и ошибку среднего (m). Графики строили в программе Excel. За уровень значимых принимали значения при p<0,05.
Экспериментальная часть.
Исследование влияния излучения на растительный организм (Серия экспериментов № 1). Влияние излучения сотового телефона на корневую меристему Allium cepa исследовалось следующим образом. В опыте луковицы помещались на 24 часа в стаканчики с дистиллированной водой для проращивания корешков. Затем корневые меристемы луковиц помещались на расстояние 1 см как от задней, так и от лицевой панелей телефона и подвергались облучению в режиме связи с имитацией разговора. При этом геометрия расположения луковиц относительно сотового телефона во время облучения сохранялась во всех опытах. Подобным образом луковицы проращивались ещё 3 дня (суммарное время облучения — 9 часов; временные интервалы между облучениями — 24 часа). Каждый опыт сопровождался интактным контролем из 5 луковиц (всего 10 луковиц). Готовили препараты из корневых меристем (не менее 30 препаратов для каждого варианта опыта и соответствующего контроля) согласно стандартной методике Allium-test. Повреждения в клетках оценивали под микроскопом Микромед-1 при увеличении 12,5×40. Учитывали на препарате число ана- и телофаз, число ХА и отставаний хромосом и число клеток с микроядрами.
Результаты серии экспериментов № 1.
Данные по микроядерному анализу представлены на рис. 4. В группе луковиц, облучённой в течение 9 часов, частота появления микроядер возросла в 9,00 раз.
Вариант |
Мя,% (X±m) |
ВМЭ |
Уровень мутагенного эффекта |
||
контроль |
0,06 |
± |
0,02 |
|
|
9 часов |
0,54 |
± |
0,07 |
9,00 |
Средний |

Рисунок 4. Сравнение частоты появления микроядер в облученной и контрольной группах.
Данные по ана-телофазному анализу представлены на рис. 5. В группе луковиц, облучённой в течение 9 часов, частота хромосомных аберраций возросла в 5,44 раза.
Вариант |
ΣХА+отс.,% (X±m) |
ВМЭ |
Уровень мутагенного эффекта |
||
контроль |
1,34 |
± |
0,49 |
|
|
9 часов |
7,29 |
± |
1,02 |
5,44 |
Средний |
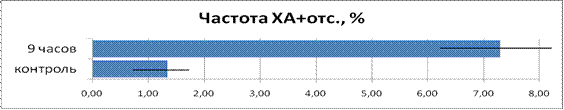
Рисунок 5. Сравнение частоты хромосомных аберраций в облученной и контрольной группах.
Таким образом, 9-часовая доза активного излучения от сотового телефона индуцирует средний уровень мутагенного эффекта в данной тест-системе.
Исследование влияния излучения на животный организм (Серия экспериментов № 2). В данном эксперименте изучалось влияние УВЧ-излучения на половые клетки самцов Drosophila melanogaster. Эксперимент проводился по стандартной методике [6]. В стаканчики с 5 мл питательной среды помещали 10—15 трёхдневных самцов линии D-32 на 72 часа. Стаканчики закрывали стерильной ватой. Каждый день в одно и то же время самцы подвергались 3-х часовому облучению, когда телефон включался в режим связи с имитацией разговора (суммарно 9 часов). Наибольшая мощность фиксировалась на расстоянии 1—2 см у экрана и у нижней части задней панели телефона. Прибор переставал улавливать излучение на расстоянии 15—20 см от телефона. Далее самцы скрещивались с интактными виргинными самками в чашках Петри. Мухи находились в чашках трое суток. Через сутки отсаживали самцов, через двое суток — самок. Чашки Петри с отложенными яйцами ставили в термостат (t=22C°) на пять суток для выхода личинки из яйца. По истечении этого времени проводился подсчет яиц под бинокулярным микроскопом (МБС-2, увеличение 8×5×1,5).
Результаты серии экспериментов № 2.
Данные по частоте ДЛМ представлены на рис. 6.
Вариант |
ДЛМ,% (X±m) |
ВМЭ |
Уровень мутагенного эффекта |
||
контроль |
1,25 |
± |
0,59 |
|
|
9 часов |
6,35 |
± |
1,86 |
5,08 |
Средний |

Рисунок 6. Сравнение частоты ДЛМ в контроле и при облучении
Как следует из графика, 9-ти часовое облучение в данной тест-системе приводит к увеличению частоты ДЛМ, которая превышает контрольный уровень в 5,08 раза. Согласно методике оценки ВМЭ (табл. 1) это соответствует среднему уровню мутагенного эффекта.
Проведенное исследование влияния УВЧ-излучения сотовых телефонов на соматические клетки Allium cepa L. и на половые клетки Drosophila melanogaster позволило зарегистрировать мутагенный эффект УВЧ-излучения сотовых телефонов во всех вариантах опытов. Полученные результаты позволяют сделать следующие выводы, представленные ниже.
1. Сравнение результатов, полученных в двух сериях опытов свидетельствуют, что УВЧ вызывает генетические нарушения как в растительных, так и в животных клетках.
2. Уровни мутагенного эффекта, индуцированные УВЧ-излучением в Allium cepa и Drosophila melanogaster, совпадают.
3. У Allium cepa мутагенное действие излучения зарегистрировано в соматических клетках — клетках меристемы. У Drosophila melanogaster мутагенный эффект зарегистрирован в половых клетках. Следовательно, УВЧ-излучение влияет сходным образом на разные типы клеток.
4. Так как эти виды далеко отстоят друг от друга на эволюционной лестнице, то можно полагать, что излучение сотовых телефонов является универсальным мутагеном, т. е. УВЧ-излучение может вызывать генетические нарушения и у человека.
Список литературы:
1. Абилев С.К., Калинина Л.М., Шапиро А.А., Перспективные методы обнаружения мутагенов, Алма-Ата: Наука, 1989, С. 93—107.
2. Изюмов Ю.Г., Литвинова Е.М., Шварцман П.Я., Реализация повреждений, индуцированных этиленнимином на разных стадиях сперматогенеза, Л.: Изд-во ЛГПИ ип. А.И. Герцена, 1974. С. 64—70.
3. Калаев В.Н., Карпова С.С., Цитогенетический мониторинг: методы оценки загрязнения окружающей среды и состояния генетического аппарата организма, Воронеж, 2004. — 80 с.
4. Песня Д.С., Романовский А.В., Прохорова И.М., Разработка методики оценки влияния сотовых телефонов и других приборов с ЭМИ РЧ на организмы in vivo, Яр. Пед. Вестник, Ярославль. Т. 3, № 3, 2010, С. 80—84.
5. Прохорова И.М., Ковалева М.И., Фомичева А.Н., Бабаназарова О.В., Пространственная и временная динамика мутагенной активности воды оз. Неро, ИБВВ РАН — М.: Наука, 2008. — 59 с.
6. Прохорова И.М., Фомичева А.Н., Ковалева М.И., Генетическая токсикология: учеб. пособие, ЯрГУ. Ярославль, 2005. — 132 с.
7. Холодов Ю.А., Шестой незримый океан, М.: Знание, 1978. — 112 с.
8. Belyaev I.Y., Grigoriev Y.G., Problems in assessment of risks from exposures to microwaves of mobile communication, Radiats Biol Radioecol., 47(6), 2007, Р. 727—732.
9. Fiskesjo G., The Allium test as a standard in environmental monitoring, Hereditas., V. 102, 1985, Р. 99—112.
10. Ruediger H.W. Genotoxic effects of RF electromagnetic fields [Text] / H.W. Ruediger. — Pathophys. V. 16 (2—3), 2009. — Р. 89—102.
11. Tkaleca M., Malarić K., Pavlicac M., Pevalek-Kozlinaa B., Vidaković-Cifreka Z. Effects of radiofrequency electromagnetic fields on germination and root meristem of Allium cepa L. [Text] / M. Tkaleca et al. — Mutat. Res. V. 672 (2), 2009, Р. 76—81.





