ИЗУЧЕНИЕ МЕДЬСОДЕРЖАЩИХ СОЕДИНЕНИЙ ГЛУТАТИОНА — ВОЗМОЖНОСТЬ ОТКРЫТЬ УНИКАЛЬНУЮ ОСНОВУ ДЛЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ДОБАВОК И ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Секция: 1. Химические науки

XII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ИЗУЧЕНИЕ МЕДЬСОДЕРЖАЩИХ СОЕДИНЕНИЙ ГЛУТАТИОНА — ВОЗМОЖНОСТЬ ОТКРЫТЬ УНИКАЛЬНУЮ ОСНОВУ ДЛЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ДОБАВОК И ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Микроэлементы — это важнейшие компоненты биохимических систем, они играют важную роль в правильном функционировании организма. Одним из необходимых микроэлементов является медь. Ионы меди необходимы для правильного развития соединительных тканей и кровеносных сосудов, а недостаток может привести к задержке роста, анемии, потере аппетита, атрофии сердечной мышцы. Нужное количество меди человек может получить с продуктами питания, но это удается не всегда, поэтому медь необходимо доставлять в организм другими способами. В свободном виде ионы меди опасны, так как обладают высокой токсичностью. Поэтому необходимо связывать ионы меди в комплексы, с помощью которых доставка меди в организм будет безопасной. В отличие от некоторых других комплексообразующих реагентов глутатион, попадая в организм, не только не вызывает побочных действий, но и сам обладает полезными свойствами. Потенциал соединений меди с глутатионом заключается не только в использовании в качестве источника меди как микроэлемента, но и создание лекарственного препарата (например, противоопухолевого).
Для установления возможности использования комплексов меди с глутатионом в качестве биодобавки или лекарственного средства, нужно изучить состав этих соединений, устойчивость и выявить их физиолого-биохимические свойства.
Цель работы.
Исследование состава, устойчивости и токсичности медьсодержащих соединений глутатиона в водном растворе.
Методы исследований.
Для исследования состава использовали методы спектрофотомерии и потенциометрии, а также инверсионный вольтамперометрический и кондуктометрический анализ.
Концентрации для приготовления исходных растворов были выбраны с учётом растворимости образующихся соединений и рабочим интервалом концентраций определяемых веществ на используемых приборах. В методе спектрофотометрии использовали способ изомолярных серий [1]. Согласно соотношению Cu:GSH варианты выбраны следующие: 9:1, 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:9. С каждого раствора сняты спектры в интервале длин волн от 190 до 250 нм на спектрофотометре ЮНИКО 2800. В ходе потенциометрического и инверсионно-вольтамперометрического определения раствор 1∙10-5 М сульфата меди (II) титровали 0,0005 М раствором глутатиона восстановленного. При потенциометрическом определении регистрировали изменение э. д. с., а при инверсионно-вольтамперометрическом — площади пиков глутатиона на вольтамперограммах [2].
В ходе кондуктометрического определения растворы солей меди (II) (брали сульфат и нитрат) с концентрацией ионов металла в растворе 1•10-5, 2•10-5, 1•10-4, 1•10-3 моль/дм3 титровали раствором глутатиона восстановленного. Регистрировали изменение электропроводности раствора на приборе “Cond 340i/SFT”.
После выявления состава, образующихся соединений, было проведено исследование токсичности некоторых растворов.
Три типа растворов, содержащих соль меди в смеси с глутатионом в соотношениях Cu:GSH равных 1:0, 1:1 и 1:4 (содержание меди во всех растворах одинаковое и равно 0,64 мг/дм3) протестировали биолюминесцентным и тетразольно-топографическим методами на культуре Nostoc linckia 273 (Т = 9,5 ∙ 109 кл/см3).
Для определения степени накопления металла культурой ЦБ в ходе контакта культуры с тестируемым раствором, был применен фракционный подход. Выделяли лиофильную, лиофобную фракции и фракцию ионов, сорбированных на поверхности клеток. Лиофильная фракция (полярные соединения) экстрагируется этанолом и метанолом, лиофобная (неполярные соединения) экстрагируется четыреххлористым углеродом и хлороформом, а фракция ионов, сорбированных на поверхности клеток — раствором ЭДТА [3]. Содержание ионов меди в исследуемых фракциях определяли методом инверсионного электрохимического анализа.
Результаты и их обсуждение.
Состав и устойчивость медьсодержащих соединений глутатиона в растворе.
Данные, полученные методом спектрофотометрии, не дали сведений о существовании соединений определенного состава, зато выявлена область соотношений, в которой наблюдается существование комплексов меди (II) и глутатиона. Соединения начинают образовываться при соотношении Cu:GSH равном 2:1. При увеличении доли глутатиона оптическая плотность, приходящаяся на образующиеся соединения, возрастает и достигает максимума при соотношении 1:6. Область длин волн, в которой возможно зафиксировать образование комплексов меди и глутатиона лежит в интервале 190—217 нм (рис. 1). К сожалению, выявить области, относящиеся к комплексам определенного состава, не удалось. Это связано с тем, что длины волн, при которых наблюдается максимум поглощения растворов индивидуальных образующихся соединений, очень близки между собой и плавно переходят друг в друга.
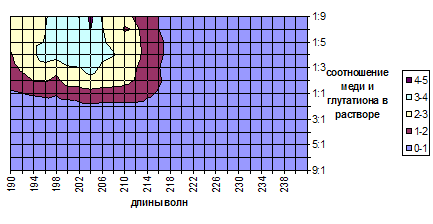
Рисунок 1. Влияние состава растворов и длины волны на оптическую плотность (график построен по данным, относящимся только к образующимся соединениям, не учитывает оптическую плотность, обусловленную исходными соединениями)
Методами инверсионно-вольтамперометрического (рис. 2) и потенциометрического титрования (рис. 3) найдено шесть соединений меди (II) с глутатионом, мольное соотношение в которых составляет 1:1, 1:2, 1:3, 1:4, 1:5, 1:6.
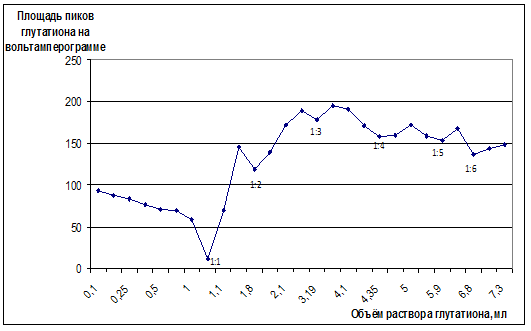
Рисунок 2. Кривая инверсионно-вольтамперометрического титрования 1∙10-5 М раствора сульфата меди (II) 0,0005 М раствором восстановленного глутатиона
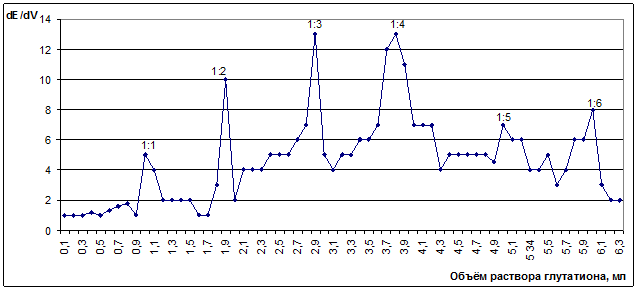
Рисунок 3. Кривая потенциометрического титрования 1∙10-5 М раствора сульфата меди (II) 0,0005 М раствором восстановленного глутатиона
Рассчитаны константы устойчивости предполагаемых соединений (табл. 1).
Таблица 1.
Значения lgk комплексов меди с глутатионом различного состава
Мольное отношение Cu:GSH |
Потенциометрия |
ИВА |
1:1 |
4,64 ± 0,05 |
6,2 ± 0,7 |
1:2 |
4,70 ± 0,05 |
3,9 ± 0,5 |
1:3 |
5,00 ± 0,05 |
4,7 ± 0,6 |
1:4 |
5,38 ± 0,06 |
5,34 ± 0,7 |
1:5 |
7,00 ± 0,07 |
6,02 ± 0,7 |
1:6 |
6,27 ± 0,07 |
6,3 ± 0,8 |
Образуемые медью с глутатионом комплексы относятся к устойчивым и могут существовать в водном растворе даже при сильном разбавлении.
По константам устойчивости можно прогнозировать токсичность соединений. Там, где медь связывается в комплекс с глутатионом в соотношении 1:1, количество свободной меди в растворе становится в два раза меньше, по сравнению с раствором без глутатиона. При соотношении Cu:GSH 1:6 количество меди уменьшается уже в 60 раз. Можно предположить, что чем больше доля глутатиона, тем меньше свободной меди остается в растворе и его токсичность становится меньше.
В ходе кондуктометрического титрования чётко удалось выявить существование только одного соединения, отвечающего составу 1:2 (рис. 4).
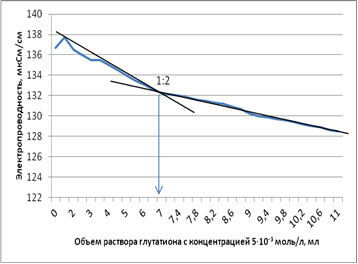
Рисунок 4. Кривая титрования раствора нитрата меди (II) с концентрацией ионов металла в растворе 1 · 10-5 моль/дм-3
Оптимальной концентрацией ионов меди (II) для кондуктометрического определения является 1 · 10-5 моль/дм-3. К сожалению, результаты не дают данных о таком многообразии соединений, как потенциометрический и инверсионно-вольтамперометрический анализ. Скорее всего, это связано с низкой селективностью метода по отношению к компонентам изучаемых соединений. Такой, на первый взгляд, явный минус данного метода может сыграть большую роль при исследовании состава и свойств медьсодержащих соединений глутатиона в ходе комплексного изучения одновременно несколькими методами, оказавшись плюсом, так как будет учитывать суммарную электропроводность, а электропроводность, обусловленную глутатионом и медью, можно будет высчитать, используя данные селективных методов.
Влияние состава медьсодержащих соединений глутатиона на жизнеспособность и интенсивность биохемилюминесценции цианобактерий.
В ходе исследования токсичности некоторых медьсодержащих соединений глутатиона получены данные, представленные на рисунках 5 и 6.

Рисунок 5. Влияние соединений меди (II) на интенсивность биохемилюминесценции цианобактерий Nostoc linckia 273: 1 — контроль (вода); 2 — Сu2+; 3 — Сu:GSH — 1:1; 4 — Сu:GSH — 1:4
Прослеживается следующую зависимость: чем больше концентрация глутатиона в растворе, тем больше свечение ЦБ (рис. 5). Особенно сильное воздействие оказывают на культуру ионы меди (II) при соотношении глутатиона и меди 1:4.
С увеличением доли глутатиона уменьшается содержание формазана в клетках ЦБ, что указывает на увеличение токсичности (рис. 6). Снижение жизнеспособности микроорганизмов указывает на то, что увеличение ИБХЛ является проявлением токсического эффекта ионов меди.
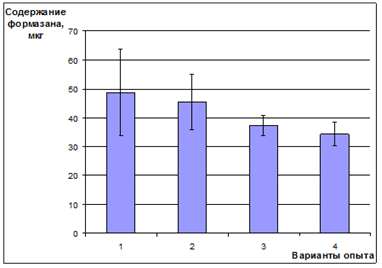
Рисунок 6. Влияние соединений меди (II) на накопление формазана клетками цианобактерий Nostoc linckia 273: 1 — контроль (вода); 2 — Сu2+; 3 — Сu:GSH — 1:1; 4 — Сu:GSH — 1:4
Известно, что лиганд (глутатион), важнейший компонент живых систем и увеличение токсичности за счёт его увеличения маловероятно. Одна из функций глутатиона — защита организма от действия ТМ, а результаты опыта показывают увеличение токсичности с ростом концентрации трипептида. Чем можно это объяснить? Помочь ответить на этот вопрос помогут результаты исследования содержания меди в различных фракциях клеток ЦБ после контакта с медь-содержащими соединениями в ходе биотестирования.
Анализ опытов с ЦБ показывает, что с увеличением доли глутатиона в растворе, появляется тенденция к увеличению содержания меди как в лиофобной так и лиофильной фракциях клеток культуры, в большей степени в лиофильной (без глутатиона — 24±8 мкг; 1:1 — 33±11 мкг и 1:4 — 44±14 мкг в лиофильной фракции; 74±22; 77±23; 96±29 мкг соответственно в лиофобной фракции). Глутатион увеличивает биодоступность меди и чем выше доля глутатиона, тем больше меди обнаружено в клетках. Соответственно, чем больше меди внутри клеток, тем токсичнее оказываются растворы согласно результатам тетразольно-топографического метода и тем интенсивнее биолюминесценция.
Выводы.
1. Исследование соединений методом спектрофотометрии не дало сведений о составе образующихся комплексов, но помогло выявить область длин волн УФ части спектра, которая поглощается данными соединениями.
2. Методом инверсионной вольтамперометрии и потенциометрии установлено существование шести соединений меди с глутатионом, состоящее из одного атома меди и от одного до шести лигандов глутатиона. С помощью кондуктометрического титрования выявили существование комплекса меди (II) и глутатиона в соотношении Cu:GSH равном 1:2. Определена нижняя граница рабочего диапазона концентраций исследуемого раствора — 1•10-5 моль/дм-3 в кислой среде.
3. Так как глутатион связывает медь в достаточно устойчивые комплексы, то можно предположить, что и токсический эффект, вызванный наличием свободной меди, будет уменьшаться с увеличением доли глутатиона в растворе.
4. Выявлено, что с увеличением доли глутатиона жизнеспособность ЦБ снижается, а ИБХЛ увеличивается. Это явление обусловлено усилением биодоступности меди в присутствии глутатиона.
5. По полученным данным исследования влияния состава медьсодержащих соединений глутатиона на ИБХЛ и жизнеспособность цианобактерий, а также на содержание меди внутри клеток микроорганизмов можно предположить, что образование комплексов меди с глутатионом положительно сказываются на биодоступности металла. Увеличение биодоступности может быть уникальным свойством, поэтому это свойство соединения меди с глутатионом может оказаться ценнейшим компонентом биологически активных добавок и лекарственных средств. Применение же различных методов анализа поможет установить состав соединений.
Список литературы:
1. Алакаева Л.А. Спектрофотометрические методы исследования комплексных соединений: учебное пособие / Л.А. Алакаева. — Нальчик, 2003. — 62 с.
2. Лялина Е.И. Некоторые особенности аналитического сигнала глутатиона получаемого методом инверсионной вольтамперометрии / Е.И. Лялина, А.И. Фокина, А.Н. Гудина [и др.] // Актуальные проблемы региональной экологии и биодиагностика живых систем: Материалы XI Всеросс. Науч.-практ. конф. — выставки инновационных экологических проектов с международным участием. — Киров, 2013. — С. 51—55.
3. Черникова А.А. Накопление меди и марганца в клетках Spirulina platensis. Автореф. … канд. биол. наук. — М., 2009. — 18 с.





