ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ БЕЛКОВ В МОЛОЧНЫХ ПРОДУКТАХ
Секция: 1. Химические науки

XVIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ БЕЛКОВ В МОЛОЧНЫХ ПРОДУКТАХ
Белки являются важной составной частью живого. Нет другого вещества с такими удивительными свойствами, как белок. Если клетке нужно совершить какую–либо работу, почти всегда её выполняет какой-нибудь белок.
Белки — это высокомолекулярные азотосодержащие органические соединения, характеризующиеся строго определенным составом и состоящие из аминокислот, соединенных в цепи с помощью пептидных связей и имеющие сложную структурную организацию.
В состав белков входят 20 аминокислот, что обуславливает огромное многообразие белков, которое объясняется множеством комбинаций аминокислотных остатков. Причем, если отсутствует хотя бы одна из незаменимых аминокислот, то прекращается биосинтез белка. В организме человека насчитывается около пяти миллионов разнообразных белков.
Общая формула белка:
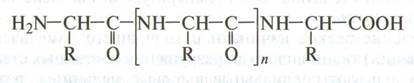
Элементарный состав белков в процентах от сухой массы отражен в таблице 1 [2].
Таблица 1.
Элементарный состав белков
Элемент |
Состав (%) |
Элемент |
Состав (%) |
углерод |
50-55 |
водород |
6,5-7,3 |
кислород |
21-24 |
сера |
0-2,5 |
азот |
15-18 |
зола |
0-0,5 |
Впервые белок был выделен Якопом Беккари в 1728 году. В отдельный же класс биологических молекул белки были выделены в XVIII веке в ходе исследований Антуана де Фуркруа и других ученых. В данных исследованиях было открыто свойство белков коагулировать под воздействием кислот или нагревания.
В настоящее время не разработана единая классификация белков. Существует несколько классификаций, в основе которых лежат разные признаки:
1. Степень сложности: простые и сложные.
2. Форма молекул: глобулярные и фибриллярные.
3. Растворимость в отдельных растворителях: альбумины, глобулины, проламины, гистоны и склеропротеины.
Линейная структура белка, образующаяся при соединении аминокислот в цепь, является первичной структурой. Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: её способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровень организации (рис. 1).
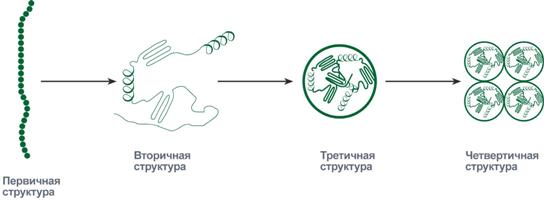
Рисунок 1. Схематичное представление последовательности укладки белков в четвертичную структуру
На уровне вторичной структуры белковые молекулы способны укладываться в упорядоченную структуру в виде спирали и в виде складчатого слоя благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями.
Укладка белка во вторичную структуру плавно переходит к формированию третичной структуры. Это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка. Движущей силой перехода является взаимодействие аминокислотных радикалов с полярным растворителем — водой.
Для большинства белков третичная структура является высшим уровнем организации. Однако есть довольно много белков, молекулы которых представляют собой комплексы, образованные из нескольких белковых молекул, соединенных не ковалентными связями. Такие комплексы называют олигомерами, а составные единицы комплексов — мономерами.
Укладку мономеров в функционально активном комплексе называют четвертичной структурой белка.
В живом организме белки выполняют различные функции, основные из них представлены в таблице 2 [1].
Таблица 2.
Функции белков и их характеристика
№ |
Функция |
Характеристика функции |
1 |
Структурная |
Участвуют в построении мембран и цитоскелета, формируют вещество соединительной ткани — коллаген, кератин, эластин. |
2 |
Ферментативная |
Ускоряют синтез и распад веществ, перенос отдельных групп атомов и электронов. |
3 |
Гормональная |
Регуляция и согласование обмена веществ в разных клетках организма (инсулин и глюкагон). |
4 |
Рецепторная |
Избирательное связывание гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутренних клеток. |
5 |
Транспортная |
Перенос веществ в крови, например, гемоглобин (транспорт кислорода), трансферрин (транспорт железа),Ca2+-АТФаза (выкачивание ионов кальция из клетки) и др. |
6 |
Резервная |
Запас молекул для питания развивающейся клетки. |
7 |
Сократительная |
Внутриклеточные белки: тубулин, актин, миозин, - предназначены для изменения формы клетки и движения самой клетки или ее органелл. |
8 |
Защитная |
Защищают при инфекционных заболеваниях и при повреждении тканей. Связывают токсичные металлы и алкалоиды. |
9 |
Когенетическая |
Помогают нуклеиновым кислотам реализовывать способность к самовоспроизведению и переносу информации. |
Белки, содержащие полный набор аминокислот, включая незаменимые, являются биологически полноценными, они содержатся в животной пище и лишь в некоторых пищевых растениях. Если принять биологическую ценность белков молока за 100, то биологическая ценность мяса и рыбы выражается числом 95, ржаного хлеба — 75, риса — 58, пшеничного хлеба —50.
При недостаточном поступлении с пищей белков, например при вегетарианстве, когда основу питания составляют растительные продукты, наблюдается белковая недостаточность, так как содержание белков в растительных продуктах меньше, а главное содержание незаменимых аминокислот. Белковая недостаточность особенно тяжело переносится в детском возрасте: наблюдается задержка роста, малокровие, поражение печени и почек, нарушается секреция пищеварительных соков, а, следовательно, и переваривание белков, поэтому полноценное питание, в том числе молочными и мясными продуктами снимает симптомы белковой недостаточности.
Пищевая ценность высока, если белок содержит все незаменимые аминокислоты в необходимых для человека пропорциях. Такому требованию отвечают многие белки животного происхождения, в том числе молоко и молочные продукты.
Целью нашей работы является определение содержания белка в молочных продуктах и выявление возможности равноценной замены молока, как ценного источника белков для нашего организма, кисломолочным продуктом — йогуртом.
Для эксперимента было взято три вида молока — пастеризованное, стерилизованное и сухое, и два вида йогуртов.
В данной работе определение содержания белков в молочных продуктах проводили рефрактометрическим методом.
В пробирку отмеривают пипеткой 5 мл анализируемого молока или йогурта, добавляют 5 капель 4 % раствора хлористого кальция. Пробирку закрывают пробкой и помещают в баню с кипящей водой на 10 минут. Затем содержимое пробирок фильтруют через складчатый фильтр. В прозрачном фильтрате, а так же в исходном молоке и йогурте определяют на рефрактометре показатель преломления при 200С.
Содержание белка в % рассчитывают по формуле:
![]() (1)
(1)
где: B — содержание белка;
n1 — показатель преломления в исходном образце;
n2 — показатель преломления фильтрате.
Полученные результаты представлены в таблице 3.
Таблица 3.
Результаты рефрактометрических измерений
Определяемые величины |
Молоко пастеризованное |
Молоко стерилизованное |
Молоко сухое |
Йогурт BIO MAX |
Йогурт BIO Баланс |
Показатель преломления в исходном образце (n1) |
1,3425 |
1,344 |
1,3422 |
1,3445 |
1,3456 |
Показатель преломления фильтрата (n2) |
1,3355 |
1,3377 |
1,3368 |
1,3376 |
1,3385 |
Содержание белка (B), % |
3,423 |
3,08 |
2,64 |
3,374 |
3,472 |
На основании полученных данных можно сделать вывод, что йогурт по процентному содержанию белка может служить равноценной заменой пастеризованного молока, а сухое и стерилизованное молоко не может в полной мере восполнять потребность в белке.
Таким образом, люди, которые не могут употреблять молоко в силу физиологических особенностей организма, могут использовать в своем рационе йогурт, как источник получения белка. Кроме того, регулярное употребление йогурта способствует хорошей работе желудочно-кишечного тракта и нормализации пищеварения.
Список литературы:
1. Биохимия для студента — [Электронный ресурс] — Режим дотупа. — URL: http://biochemistry.terra-medica.ru/lekcii-po-biohimii/13-belki/272-function.html (дата обращения 13.11.2014).
2. Филиппович Ю.Б., Ковалевская Н.И. и др. Биологическая химия: учеб. пособие. — М.: Академия, 2009. — 256 с.





