ЗНАЧЕНИЕ СПЕЦИФИЧЕСКОГО ФОТОПЕРИОДИЗМА РЕСПУБЛИКИ САХА (ЯКУТИЯ) В ПРОЦЕССАХ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ НЕЙРОНОВ ГОЛОВНОГО МОЗГА СТАРЫХ КРЫС
Секция: 4. Медицинские науки

XVIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ЗНАЧЕНИЕ СПЕЦИФИЧЕСКОГО ФОТОПЕРИОДИЗМА РЕСПУБЛИКИ САХА (ЯКУТИЯ) В ПРОЦЕССАХ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ НЕЙРОНОВ ГОЛОВНОГО МОЗГА СТАРЫХ КРЫС
В настоящее время о геропротекторных свойствах мелатонина и его способности увеличивать продолжительность жизни свидетельствуют работы многих авторов [14; 12; 2; 10; 16; 3]. Согласно свободно-радикальной теории старения в процессе биологического окисления образуются активные формы кислорода (АФК), индуцирующие перекисное окисление липидов (ПОЛ) — основной механизм возникновения не только старения, но и связанных с ним патологий, таких как катаракта, атеросклероз, заболевания сердца, суставов, злокачественные новообразования, нейродегенеративные заболевания и др. [8; 18; 5; 15; 9; 11].
Являясь мощнейшим эндогенным антиоксидантом, мелатонин способен замедлять процессы старения, непосредственно нейтрализуя АФК и тем самым предотвращая свободнорадикальное повреждение нуклеиновых кислот, белков и липидов [14; 2; 10; 3; 7].
В процессе ПОЛ внутри клеток откладывается особый пигмент — липофусцин, представляющий собой продукты оксидации и пероксидации жиро-белковых комплексов клеточных мембран, не поддающихся гидролитическому действию лизосомальных ферментов [1]. В большей степени липофусцин накапливается нейронах и кардиомиоцитах, что связано, во-первых, с отсутствием их митотической активности, во-вторых, с интенсивным метаболизмом, т. е. с потреблением большего количества кислорода, что влечет за собой большее образование АФК [17]. Поскольку наиболее важным регулятором секреции мелатонина является чередование циркадианного цикла дня и ночи, степень накопления липофусцина в нейронах старых белых крыс при разных световых режимах находится в прямой зависимости от активности ПОЛ в клетках и в обратной зависимости от антиоксидантной активности мелатонина, что может служить маркером интенсивности ПОЛ.
Отсутствие на сегодняшний день в литературе систематизированных данных влияния на функционирование эпифиза и секрецию мелатонина сезонных и циркадианных ритмов в резко континентальном климате северного региона, отличающееся высоким диапазоном различий соотношения дня и ночи в разные времена года, обуславливает актуальность и необходимость дальнейших исследований в данном направлении.
Таким образом, целью данной работы является исследование внутриклеточного содержания липофусцина как маркера перекисного окисления липидов в нейронах коры головного мозга старых белых крыс, содержавшихся в режимах искусственного и естественного освещения в условиях Республики Саха (Якутия).
Материалы и методы.
В работе использованы старые (22 мес.) белые беспородные крысы массой 350—400 г. Животные были разделены на 3 группы, содержавшиеся при разных режимах освещения в течение 30 дней: 1 группа — в условиях световой депривации (DD), 2 группа — при постоянном освещении (LL), 3 группа — в условиях естественного освещения Республики Саха (Якутия) в период максимально измененного фотопериодизма («белых ночей») (NL). В каждой группе имелись представители обоих полов. Эксперимент проводился в условиях одного вивария, животные содержались в условиях ad libitum. После декапитации левое полушарие головного мозга разрезалось во фронтальной плоскости, строго перпендикулярно длиннику и верхней поверхности по схемам Светухиной. Взятый материал фиксировали в жидкости Карнуа в течение 1 ч. Последующую заливку в парафин осуществляли стандартным способом. На срезах переднетеменной доли и собственно теменной доли головного мозга толщиной 7 мкм проводили гистохимическое выявление липофусцина в нейронах по методу Циля-Нильсена и Шморля. Фотографии препаратов получены с помощью цифровой фотокамеры ToupCam. Количественная оценка содержания липофусцина в нейронах проводилась измерением его оптической плотности (ОП) при помощи морфометрической программы PhotoМ1.21. В каждом случае измерялось не менее 5 клеток. Измерения проводились в нейронах II и V слоев неокортекса переднетеменной и собственно теменной долей. Общее количество обработанных фотографий — 240. Статистический анализ полученных данных проведен с помощью программы Statistica 10. Достоверность различий определялась по критерию Стьюдента, различия считали достоверными при р<0,05.
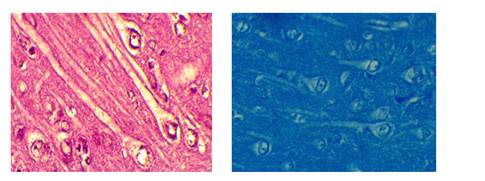
а б
Рисунок 1. Гранулы липофусцина в нейронах V слоя неокортекса старых крыс: а) окраска карбол-фуксином по методу Циля-Нильсена; б) окраска гексацианоферратом по методу Шморля. Увеличение 10*40
Результаты и обсуждения.
Полученные нами данные свидетельствуют, что у старых крыс, содержавшихся в разных режимах освещения, количественное содержание липофусцина в нейронах коры головного мозга имеет достоверные различия (табл.).
Таблица 1.
Количественное содержание липофусцина в нейронах неокортекса старых крыс, содержавшихся в режимах искусственного и естественного освещения в условиях
Республики Саха (Якутия)
|
Группа
Показатель |
1-я группа Световая депривация (DD) |
2-я группа Естественное освещение (NL) |
3-я группа Темновая депривация (LL) |
|
|
ОП липофусцина: |
Карбол-фуксин по методу Циля-Нильсена |
|
||
|
ПТД: — II слой — V слой |
0,189±0,058 0,169±0,038 |
0,159±0,020 0,141±0,018 |
0,215±0,048 0,241±0,054 |
|
|
СТД: — II слой — V слой |
0,117±0,024 0,134±0,025 |
0,234±0,057 0,245±0,060 |
0,245±0,049* 0,277±0,090 |
|
|
ОП липофусцина: |
Гексацианоферрат по методу Шморля |
|
||
|
ПТД: — II слой — V слой |
0,156±0,046 0,091±0,039 |
0,164±0,047 0,135±0,036 |
0,197±0,039 0,246±0,041** |
|
|
СТД: — II слой — V слой |
0,171±0,028 0,166±0.051 |
0,173±0,020 0,203±0,038 |
0,175±0,030 0,212±0,026 |
|
Примечание: * — отличия статистически достоверны по сравнению с 1 группой; ** — отличия статистически достоверны по сравнению со 2-й группой (Р<0,05).
Так как оптическая плотность липофусцина прямо пропорциональна его концентрации в цитоплазме клеток, ее измерение при помощи компьютерной морфометрии дает возможность относительного количественного сравнения содержания липофусцина в нейронах неокортекса крыс в разных экспериментальных группах. Так, обнаружено, что во II слое собственно теменной доли неокортекса содержание липофусцина у крыс, находившихся при постоянном освещении (LL), достоверно не отличалось от группы в естественных условиях (NL), однако по сравнению с группой, находившейся в темноте (DD), наблюдалось достоверное увеличение накопления пигмента. В нейронах V слоя неокортекса переднетеменной доли крыс, подвергнутых темновой депривации (LL), наблюдается достоверно повышенное содержание пигмента по сравнению с 1-й (DD) и 2-й (NL) экспериментальными группами. Показатели липофусцина нейронов крыс, находившихся в условиях естественного фотопериодизма РС (Я) (NL) были сходны с показателями группы при постоянном освещении (LL).
Согласно полученным данным, животные, содержавшиеся при постоянном освещении, содержали наибольшее количество липофусцина в нейронах. Данный факт может расцениваться как следствие угнетения секреции мелатонина световым загрязнением, что увеличивает свободно-радикальное повреждение клеток, приводящее к более интенсивному накоплению липофусцина. Учитывая то, что липофусцин является продуктом ПОЛ, можно сделать вывод о том, что избыточное освещение путем угнетения секреции мелатонина увеличивает степень интенсивности ПОЛ, а значит, ускоряет процесс старения.
Заключение. Мелатонин, обладая антиоксидантными свойствами, замедляет процессы старения организма и предотвращает от связанных с ним заболеваний, т. е. является геропротектором. Главным регулятором секреции мелатонина является естественная смена дня и ночи, равновесие между светом и темнотой. Изобретение электричества, ставшего неотъемлемой частью жизни современного человека, значительно сместило это равновесие в сторону света. Воздействие света в ночное время, называемое световым загрязнением, угнетает секрецию мелатонина и тем самым увеличивает свободно-радикальное повреждение клеток, что негативно отражается на продолжительности жизни и сопровождается множеством серьезных расстройств, таких как сердечно-сосудистые, нейродегенеративные заболевания и злокачественные новообразования [4]. Наличие такого явления как белые ночи в фотопериодизме северных регионов, таких как Республика Саха (Якутия), в сочетании со световым загрязнением оказывает непосредственное влияние на мелатонинсинтезирующую функцию эпифиза проживающих в этих регионах людей, а значит, и на их продолжительность жизни, а также определяет течение многих заболеваний. Все вышесказанное определяет несомненную актуальность дальнейших исследований данной проблемы в условиях Республики Саха (Якутия). Полученные нами морфометрические данные могут быть использованы для сравнения в работах по исследованию взаимосвязи процессов старения, эндокринной функции эпифиза и фотопериодизма Республики Саха (Якутия).
Список литературы:
1. А.А. Ефимов Г.Н. Маслякова. О роли липофусцина в инволютивных и патологических процессах. // Саратовский научно-медицинский журнал, 2009, том 5 № 1 С. 111—115.
2. Анисимов В.Н. // Молекулярные и физиологические механизмы старения 2 т. — 2-е изд. Перераб — Спб.: Наука, — 2008 — Т. 1 и доп. С. 170, С. 314.
3. Анисимов В.Н. Мелатонин: роль в организме, применение в клинике // Спб.: Наука, — 2005, С. 57—61.
4. Анисимов В.Н., Виноградова И.А.: Световой режим, мелатонин и риск развития рака // Вопросы онкологии, 2006 т. 52 № 5 С. 491.
5. Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник. — 3-е изд., перераб. И доп. // М.: Медицина, 1998 — С. 314—316.
6. Бойко Е.Р.: Влияние продолжительности светового дня на гормональные и биохимические показатели у человека на Севере // Физиологический журнал им. И.М. Сеченова. 1995. — Т. 81, № 7. — С. 86—92.
7. В.К. Кольтовер Свободно-радикальная теория старения // «Успехи геронтологии», 2000 г., выпуск 4 Т. 3, С. 38 Декабрь, 2002.
8. Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах // Итоги науки и техники. Сер. Биофизика. 1991. Т. 29.
9. Е.С. Северин. Учебник по биохимии — 2-е изд., испр. // М.: ГЭОТАР-МЕД, 2004 — С. 428—432.
10. И.Н. Тодоров, Г.И. Тодоров. Стресс, старение и их биохимическая коррекция // М. Наука, 2003. — С. 58, С. 62—64, С. 134—135.
11. Кулинский В.И. Лекционные таблицы по биохимии // Иркутск: Иркут. мед. ин-т, 1994. Вып. 4: Биохимия регуляций. 94 с.
12. Левин Я.И. Мелатонин и неврология // РМЖ, 2009. — С. 26.
13. Поскотинова Л.В.: Вегетативная регуляция ритма сердца в зависимости от утреннего уровня мелатонина у подростков при умственной нагрузке на Севере // Авиакосмическая и экологическая медицина. — 2008. — Т. 42. — № 3. — С. 38—43.
14. С.И. Рапопорт, В.А. Голиченков. Мелатонин: Теория и практика // — М.: ИД «Медпрактика М», 2009. — С. 13.
15. Lander H.M. // FASEB J. 1997. Vol. 11, № 1. P. 118—124.
16. Reiter R.J., Tan D.X., Sainz R.M., Mayo J.M., Lopez-Burillo S. (2002) Melatonin: reducing the toxicity and increasing the efficacy of drugs. // J Pharm Pharmacol 75:1299—1321.
17. Shimasaki H., Nozawa T., Privett O.S., Anderson W.R. Arch. // Biochem. Biophys., 183, 443—451 (1977).
18. Suzuki Y.J., Forman H.J., Sevanian A. // Free Radical Biol. Med. 1996. Vol. 22, № 1/2. P. 269—285.





