ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВЕННОГО СОДЕРЖАНИЯ ФЛАВОНОИДОВ, КИСЛОТЫ АСКОРБИНОВОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТИ В ЛЕКАРСТВЕННОМ РАСТИТЕЛЬНОМ СЫРЬЕ, ОБЛАДАЮЩЕГО ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ
Секция: 1. Химические науки

XXIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВЕННОГО СОДЕРЖАНИЯ ФЛАВОНОИДОВ, КИСЛОТЫ АСКОРБИНОВОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТИ В ЛЕКАРСТВЕННОМ РАСТИТЕЛЬНОМ СЫРЬЕ, ОБЛАДАЮЩЕГО ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ
Для лечения заболеваний печени и желчевыводящих путей в настоящее время в мировой практике имеется достаточно большой ассортимент лекарственных средств — гепатопротекторов синтетического и природного происхождения. Согласно современным представлениям, гепатопротекторное действие может быть обусловлено желчегонным действием, регенерирующей способностью в отношении клеток и тканей, антиоксидантной активностью (АОА). Учитывая тот факт, что одним из механизмов повреждения клеток и тканей является неконтролируемый окислительный стресс, следовательно, одним из аспектов исследования гепатопротекторного действия является определение АОА, которая обусловлена наличием в лекарственном растительном сырье (ЛРС) таких биологически активных веществ (БАВ), как витамины Е, С, А, флавоноиды, дубильные вещества. Механизм действия данных соединений состоит главным образом в обрыве реакционных цепей: молекулы антиоксиданта взаимодействуют с активными радикалами с образованием малоактивных соединений, неспособных вступать в реакции неконтролируемого окисления. Источниками указанных соединений является сырье травы тысячелистника обыкновенного, листьев мяты перечной, травы чистотела большого, цветков бессмертника песчаного [3].
Целью настоящей работы явился сравнительный анализ содержания кислоты аскорбиновой, флавоноидов, выраженности суммарной антиоксидантной активности в сырье, обладающем гепатопротекторным действием.
Объектом исследования явилось сырье, приобретенное в аптечной сети: трава тысячелистника обыкновенного (Achillea millefolium) семейства астровые (Asteraceae); листья мяты перечной (Mentha piperita) семейства губоцветные (Lamiaceae); трава чистотела большого (Chelidonium majus) семейство маковые — (Papaveraceae); цветки бессмертника песчаного (Helichrysum arenarium) семейства астровые (Asteraceae).
Содержание кислоты аскорбиновой проводили методом визуального титрования, используя окислительно-восстановительную реакцию с 2,6-дихлорфенолиндофенолятом натрия (реактивом Тильманса) [4]. Метод основан на редуцирующих свойствах аскорбиновой кислоты. Синяя окраска восстанавливается в бесцветное соединение аскорбиновой кислотой. При этом аскорбиновая кислота окисляется до дегидроаскорбиновой кислоты. 2,6-дихлорфенолиндофенол имеет разную окраску при различных значениях рН среды. Интенсивный синий цвет в щелочной среде и бледно-красный в кислой среде. Переход окраски происходит между рН 4 и 5, в этом интервале индикатор имеет фиолетовый цвет. При окислительно-восстановительных реакциях тёмно-синий цвет соответствует окисленному состоянию, а восстановленный — бесцветному. Для количественного определения отбирали пробу среднюю пробу методом квартования. Среднюю пробу предварительно грубо измельчают в ступке. Из аналитической пробы сырья берут навеску массой 20 г, помещают в фарфоровую ступку, где тщательно растирают со стеклянным порошком, постепенно добавляя 300 мл воды, затем настаивают 10 мин. После этого смесь размешивают, и извлечение фильтруют. В коническую колбу вместимость 100 мл вносят 1 мл полученного фильтрата, 1 мл 2 % раствора хлористоводородной кислоты, 13 мл воды, перемешивают и титруют из микробюретки раствором 2,6-дихлорфенолиндофенолята натрия до появления розовой окраски, не исчезающей в течение 30—60 секунд. Титрование продолжают не более 2 минут. Расчёт содержания аскорбиновой кислоты в мг % производили по следующей формуле:
X, %![]() ;
;
где: 0,000038 — количество аскорбиновой кислоты, соответствующее 1 мл раствора 2,6-дихлорфенолиндофенолята, в граммах; V — объём раствора 2,6-дихлорфенолиндофенолята натрия, пошедшего на титрование, в миллилитрах; m — масса сырья в граммах; W — потеря в массе при высушивании сырья, в процентах.
Количественное определение флавоноидов проводили спектрофотометрическим методом, основанном на поглощении монохроматического электромагнитного излучения [5]. Аналитическую пробу сырья измельчали до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм. Около 0,5 г (точная навеска) измельченного сырья помещали в колбу со шлифом вместимостью 100 мл, прибавляли 50 мл 70 % спирта этилового. Колбу взвешивали с погрешностью ± 0,01, присоединяли к обратному холодильнику и нагревали на кипящей бане в течение 2 ч. После охлаждения до комнатной температуры колбу вновь взвешивали и доводили до первоначальной массы 70 % спиртом этиловым. Содержимое колбы фильтровали через воронку диаметром 7 см с вложенным ватным тампоном, отбрасывая первые 20 мл фильтрата. В мерную колбу вместимостью 25 мл помещали 2 мл профильтрованного извлечения, добавляли 2 мл 1 % раствора алюминия хлорида в 95 % спирте этиловом и доводили объём раствора 95 % спиртом этиловым до метки. Для приготовления раствора сравнения в другую колбу вместимостью 25 мл помещают 2 мл фильтрата и доводят до метки 95 % спиртом этиловым. Измерение оптической плотности проводили через 29 минут на спектрофотометре при длине волны 400 нм в кювете с толщиной слоя 10 мм. Параллельно измеряли оптическую плотность раствора ГСО кверцетина. Для этого 2 мл 0,02 % раствора стандарта помещали в мерную колбу 25 мл, прибавляли 2 мл 1 % раствора алюминия хлорида и доводили до метки 95 % спиртом этиловым. Суммарное содержание флавоноидов в сухом сырье в пересчете на стандарт и абсолютно сухое вычисляли по следующей формуле:
X, % =![]() ;
;
где: D — оптическая плотность испытуемого раствора; D0 — оптическая плотность раствора ГСО стандарта; m — масса сырья, в граммах; m0 — масса ГСО стандарта, в граммах; W — потеря в массе при высушивании сырья, в процентах.
Определение антиоксидантной активности основано на способности антиоксидантов ингибировать аутоокисление адреналина “in vitro” и тем самым предотвращать образование активных форм кислорода. К 4 мл 0,2 М натрий — карбонатного буфера, рН = 10,65 добавляли 0,2 мл 0,1 % аптечного раствора адреналина гидрохлорида, тщательно и быстро перемешивали, помещали в спектрофотометр “GENEZYS 5” и определяли оптическую плотность через 30 сек. в течение 10 мин при длине волны 347 нм в кювете толщиной 10 мм на спектрофотометре СФ-46. Далее к 4 мл буфера добавляли 0,06 мл исследуемого экстракта и 0,2 мл 0,1 % адреналина гидрохлорида, перемешивали и измеряли оптическую плотность. Для учёта влияния собственной окраски экстрактов, которые поглощают определенную длину волны в видимой части спектра, в качестве контрольной пробы использовали буферированный раствор экстрактов, без адреналина. Антиоксидантную активность выражали в процентах ингибирования аутоокисления адреналина и вычисляли по следующей формуле:
АА, % =![]() ;
;
где: D1 — оптическая плотность раствора адреналина гидрохлорида, добавленного к натрий-карбонатному буферу; D2 — оптическая плотность исследуемого экстракта и адреналина гидрохлорида, добавленного к натрий-карбонатному буферу.
Статистическую обработку проводили с использованием программы Microsoft Excel 2010.
Исследование биологически активных соединений в изучаемом ЛРС установило, что содержание кислоты аскорбиновой в исследуемом ЛРС убывает в ряду: Mentha piperita > Helichrysum arenarium> Chelidonium majus > Achillea millefolium (рис. 1).
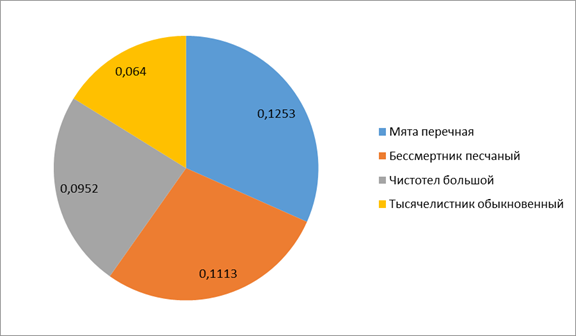
Рисунок 1. Содержание аскорбиновой кислоты в ЛРС, %
Содержание флавоноидов в ЛРС колеблется в интервале от 0,16 % (Chelidonium majus) до 2,73 % (Helichrysum arenarium) (рис. 2).

Рисунок 2. Содержание флавоноидов в исследуемом сырье, %
Изучение выраженности антиоксидантной активности в исследуемом ЛРС показало наибольшую величину данного показателя в мяте перечной, а наименьшую — в сырье чистотела большого (рис. 3).

Рисунок 3. Содержание суммарной антиоксидантной активности, %
Таким образом, проведенный анализ содержания биологически активных веществ и выраженности антиоксидантной активности в ЛРС, обладающим гепатопротекторным действием установил, что по выраженности антиоксидантного действия первое место занимает мята перечная, на втором месте — тысячелистник обыкновенный, что может быть обусловлено высоким содержанием флавоноидов у данного сырья. Наименьшее содержание АОА выявили у бессмертника песчаного и чистотела большого, что, вероятно, связано с низким содержанием в них изучаемых БАВ.
Учитывая полученные результаты и данные литературы [3; 5], можем предположить, наличие синергических связей между данными БАВ, что ещё больше усиливает антиоксидантный эффект, нежели каждого в отдельности.
Список литературы:
1. Государственная фармакопея СССР XI издания выпуск 1, — М.: Медицина, 1990. — С. 286.
2. Государственная фармакопея СССР XI издания выпуск 2, — М.: Медицина, 1990. — С. 294—297.
3. Куркин В.А. Фармакогнозия / В.А. Куркин // Учебник для студентов фармацевтических вузов. — Самара, 2004. — 996 с.
4. Рябинина Е.И. Новый подход в оценке антиоксидантной активности растительного сырья при исследовании процесса аутоокисления адреналина / Е.И. Рябинина, Е.Е. Зотова, Е.Н. Ветрова, Н.И. Пономарева, Т.Н. Илюшина // Химия растительного сырья. — 2011. — № 3 — С. 117.
5. Уткина Е.А. Зависимость антиоксидантной активности флавоноидов от физикохимических характеристик в различных системах / Е.А. Уткина // Автореф. дис. канд. мед. наук. — М., 2005. — 114 с.





