ИЗУЧЕНИЕ КИНЕТИКИ ХИМИЧЕСКОЙ РЕАКЦИИ
Секция: 1. Химические науки

XXIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ИЗУЧЕНИЕ КИНЕТИКИ ХИМИЧЕСКОЙ РЕАКЦИИ
В данной работе преимущественно исследовательского характера рассматриваются вопросы химической кинетики, влияние на скорость химической реакции концентрации реагирующих веществ на примере практически значимой реакции между тиосульфатом натрия и серной кислотой. Экспериментально обосновывается независимость скорости реакции от концентрации серной кислоты. Используется метод оптического анализа совместно с КФК-2. Экспериментально определяется температурный коэффициент реакции.
Не вызывает сомнений ценность вопросов, связанных с предметом химической кинетики, то есть со скоростью и механизмом химической реакции. Это одна из базовой составляющей современного теоретического аппарата химии. Взяв за основу известную всем реакцию между тиосульфатом натрия и серной кислотой, мы организовали самостоятельное учебное исследование, в том числе с применением инструментальных методов количественного анализа.
При изучении соответствующей темы на лабораторных занятиях подобный опыт проводился только лишь на качественном уровне, измеряя время до появления визуально заметного помутнения. С целью усовершенствования опыта и повышения эффективности исследования мы перешли от исключительно качественной оценки наблюдаемых явлений к анализу количественных характеристик и измерению величин во времени. В данной работе исследовалась зависимость скорости реакции между Na2S2O3 и H2SO4 отдельно как от концентрации тиосульфата натрия, так и серной кислоты, а также скорости реакции от температуры.
Для определения зависимости скорости реакции от концентрации нам потребовались следующие реактивы и оборудование: дистиллированная вода, 0,1 М раствор тиосульфата натрия, 0,5 М и 0,1 М растворы серной кислоты, фотоколориметр КФК-2, набор кювет, стаканов и мерных цилиндров.
При взаимодействии растворов тиосульфата натрия и серной кислоты наблюдается помутнение раствора, обусловленное образованием элементарной серы. Суммарный процесс выражается уравнением:
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O. (1)
На самом деле здесь протекает более сложная реакция, включающая несколько стадий. Продукт реакции — сера — появляется не сразу; процесс протекает в несколько стадий:
Na2S2O3 = 2Na+ + S2O32- (2)
S2O32- + H+ = HS2O3- (3)
HS2O3- = HSO3- + S↓ (4)
HSO3- + S2O32- = HS2O3- + SO32- (5)
Видно, что роль серной кислоты сводится только к образованию на второй стадии ионов HS2O3-. Лимитирующей стадией является последняя. Изучаемая реакция имеет первый порядок по тиосульфат-аниону и нулевой порядок по катионам водорода, то есть ее скорость прямо пропорциональна концентрации Na2S2O3, и не зависит от концентрации серной кислоты.
Для измерения скорости данной реакции мы воспользовались фотоколориметром КФК-2. Частички образующейся серы рассеивают свет. Раствор освещается световым потоком определенной длины волны и измеряют интенсивность прошедшего излучения. Данный метод химического анализа называют турбидиметрией. Мутность раствора соответствует оптической плотности. Нами была выбрана определенная оптическая плотность (мутность), которой достигает раствор через определенный промежуток времени; это значение постоянно для всей серии опытов: D = 1,0. При этом отношение 1/t называется условной скоростью реакции. λ = 490 нм. (соответствует максимуму пропускания на растворе стравнения).
Сначала мы рассмотрели зависимость скорости реакции от концентрации раствора тиосульфата натрия. Были приготовлены следующие рабочие растворы Na2S2O3 (таблица 1).
Таблица 1.
Рабочие растворы тиосульфата натрия
Номер раствора |
1 |
2 |
3 |
4 |
5 |
Объем 0,1 М раствора Na2S2O3, мл. |
7 |
5 |
4 |
3 |
2 |
Объем воды, мл. |
0 |
2 |
3 |
4 |
5 |
Приливаем в кювету 30 мм определенное количество серной кислоты, стараясь не попасть раствором на внешние стенки кюветы. Стабилизируем показания прибора на ноль. Быстро и аккуратно приливаем весь заготовленный тиосульфат натрия и засекаем время начала опыта. При достижении оптической плотности D= 1,0 прекращаем измерения и записываем полученный результат. Результаты исследования зависимости скорости реакции от концентрации раствора тиосульфата натрия приведены в таблице 2.
Примеры расчетов в таблице приведены ниже.
Приготовление 0,1 М раствора Na2S2O3. Молярная масса М(Na2S2O3∙5Н2О)=248 г/моль; на весах 24,8 г. — на 1 литр раствора.
Приготовление растворов серной кислоты. Молярная масса М (H2SO4 ) = 98 г/моль. Плотность ρ=1,8 г/мл. Для приготовления 1 литра 0,1 М раствора кислоты берем V1 = 9,8/1,8 = 5,4 мл кислоты; для приготовления 0,5 М раствора — 27,2 мл.
Расчет количества вещества. ν (Na2S2O3) = См∙V = 0,1∙0,007= 7∙10-4 моль.
Расчет молярной концентрации. С (Na2S2O3) = ν / V = 7∙10-4 / 14∙10-3 = =0,05 М.
Таблица 2.
Результаты исследования зависимости скорости реакции от концентрации раствора тиосульфата натрия
Номер опыта |
1 |
2 |
3 |
4 |
5 |
Объем 0,1 М раствора Н2SO4, мл. |
7 |
7 |
7 |
7 |
7 |
Объем 0,1 М раствора Na2S2O3, мл. |
7 |
5 |
4 |
3 |
2 |
ν (Na2S2O3), моль |
7∙10-4 |
5∙10-4 |
4∙10-4 |
3∙10-4 |
2∙10-4 |
С (Na2S2O3), моль/л |
0,05 |
0,04 |
0,03 |
0,02 |
0,01 |
t, с |
55 |
77 |
102 |
154 |
321 |
V, с-1 |
0,018 |
0,013 |
0,010 |
0,007 |
0,003 |
На основе полученных экспериментальных данных строим график зависимости скорости реакции от концентрации тиосульфата натрия. Зависимость линейная, причем реакция имеет первый порядок по тиосульфат — иону (рисунок 1).
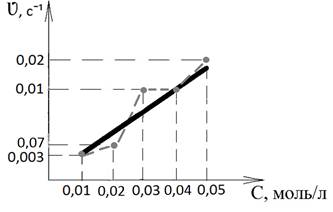
Рисунок 1. Зависимость скорости реакции от концентрации тиосульфата натрия
Проведем дополнительное исследование, нацеленное на установление зависимости скорости изучаемой реакции от концентрации серной кислоты (катионов Н+).
Эта зависимость устанавливается аналогичным образом. Приготовим рабочие растворы серной кислоты (таблица 3).
Таблица 3.
Рабочие растворы серной кислоты
Номер раствора |
1 |
2 |
3 |
4 |
5 |
Объем 0,5 М |
7 |
5 |
4 |
3 |
2 |
Объем воды, мл. |
0 |
2 |
3 |
4 |
5 |
Действуя по знакомому алгоритму, отметим результаты исследования в таблицу 4.
Таблица 4.
Результаты исследования зависимости скорости реакции от концентрации раствора серной кислоты
№ опыта |
1 |
2 |
3 |
4 |
5 |
Объем 0,5 М |
7 |
5 |
4 |
3 |
2 |
Объем 0,1 М |
7 |
7 |
7 |
7 |
7 |
ν (Н2SO4), моль |
3,5∙10-3 |
2,5∙10-3 |
2∙10-3 |
1,5∙10-3 |
10-3 |
С (Н2SO4), моль/л |
0,25 |
0,15 |
0,14 |
0,11 |
0,07 |
t, с |
35 |
37 |
37 |
40 |
42 |
V, с-1 |
0,03 |
0,03 |
0,03 |
0,03 |
0,03 |
Строим график зависимости (рисунок 2). При этом отмечаем, что концентрация раствора кислоты практически не влияет на скорость изучаемой реакции, и делаем вывод, что реакция между тиосульфатом натрия и серной кислотой имеет нулевой порядок по катионам водорода.

Рисунок 2. Зависимость скорости реакции от концентрации серной кислоты
Последний этап нашего исследования — установление зависимости скорости реакции от температуры и определение температурного коэффициента в уравнении Вант-Гоффа: ![]() .
.
Помимо вышеприведенных реактивов, нам потребовались термометры с диапазоном 0-100оС и кристаллизатор со льдом. Для реакции брали одинаковые количества 0,1 М растворов исходных веществ. Использовали следующие температуры растворов: горячую воду (650С), теплую воду (480С), комнатную температуру (290С), холодную воду (120С), холодную воду со льдом (50С). Растворы термостатировали не менее 5—7 мин. Затем действовали по уже отработанному механизму. Результаты приведены в таблице 5.
Таблица 5.
Результаты исследования зависимости скорости реакции от температуры
Номер опыта |
1 |
2 |
3 |
4 |
5 |
Температура растворов, оС |
50С |
120С |
290С |
480С |
650С |
t, с |
101 |
86 |
55 |
19 |
9 |
V, с-1 |
0,009 |
0,012 |
0,018 |
0,053 |
0,111 |
Используя обобщенные значения, рассчитываем температурный коэффициент скорости реакции: ![]() . Среднее значение:
. Среднее значение: ![]() =1,5.
=1,5.
Выполняя работу, мы соблюдали меры предосторожности при работе с кислотой. В ходе реакции выделяется сернистый газ, поэтому все отработанные растворы мы сливали ставили под тягу. Осадок серы отмывался со стенок кюветы сразу, во избежание выхода ее из строя. При этом нужно отметить, что нам не удалось устранить диффузионные эффекты, связанные с недостаточным перемешиванием раствора, также для упрощения расчетов мы принимали плотности растворов, близкие к 1 г/мл.
В данном докладе с помощью методов инструментального количественного анализа, на новом уровне мы рассмотрели зависимость скорости реакции от концентрации с применением закона действующих масс, выяснили порядок реакции взаимодействия тиосульфата натрия с серной кислотой. В ходе проведенного исследования мы установили, что изучаемая реакция сложная, протекает в несколько стадий, причем лимитирующая стадия не сводится к начальному (общему) уравнению реакции. Выяснили кинетическое уравнение для данной реакции. Надеемся, что данный усовершенствованный опыт окажет помощь в понимании процессов химической кинетики.
Список литературы:
1. Коровин Н.В. Общая химия. — М.: Высш.шк., 2000. — 558 с.
2. Дорофеева М.В., Беспалов П.И. Изучение скорости химической реакции с использованием цифровой лаборатории // «Химия в школе», 2011, — № 8. — С. 43—50.
3. Медведев Ю.Н. Скорость и механизмы химических реакций // «Химия в школе». — 2010. — № 6. — С. 57—63.





