ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ПО ГЕНАМ УСТОЙЧИВОСТИ К ПАРАЗИТАРНЫМ ЗАБОЛЕВАНИЯМ
Секция: 2. Биологические науки

XXIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ПО ГЕНАМ УСТОЙЧИВОСТИ К ПАРАЗИТАРНЫМ ЗАБОЛЕВАНИЯМ
Генетический полиморфизм — существование в единой популяции двух и более резко различающихся аллелей одного и того же гена. Примеры, группы крови -АВ0, система HLA.
Система HLA представляет собой специфический набор различного типа белковых молекул, находящихся на поверхности клеток. Этот набор антигенов уникален для каждого человека. Данная система обеспечивает выживание человека как вида в условиях экзогенной и эндогенной агрессии. Реализация столь многочисленных функций в организме обеспечивается крайне выраженным полиморфизмом этой генетической системы, которая у человека насчитывает более 2 тысяч аллельных вариантов вероятно, именно в ответ на селективный пресс патогенов система HLA стала наиболее полиморфной из известных систем в организме человека. Паразитарные болезни являются многофакторными и зависят от генетического полиморфизма хозяина, окружающей среды, генетической вариабельности паразитов. В настоящее время в человеческом геноме обнаружено несколько сотен известных генных вариантов или однонуклеотидных полиморфизмов встречающихся у 5—50 % населения. Некоторые из этих генетических аберраций способны оказывать влияние на исход заболевания. Подобные генетические аномалии могут обеспечивать резистентность носителя к определенным возбудителям, существенно снижая вероятность летального исхода болезни или, наоборот, служить генами предрасположенности к заболеванию.
Рассматриваемая мною тема действительно актуальна в сегодняшние дни, доказательство тому цифры:
1. К настоящему времени из 1415 известных возбудителей заболеваний человека 353 возбудителя вызывают протозойные заболевания и гельминтозы.
2. Массовое распространение паразитарных болезней: инвазированы 4 миллиардов человек.
3. В России ежегодно официально регистрируют около 1,5 млн. случаев паразитарных болезней.
4. По некоторым данным только от малярии ежегодно умирает 1,5—3 млн. человек, что в 15 раз больше чем от СПИДА, а самое распространенное заболевание — лямблиоз, которым поражены 20—30 % населения Земли.
Поэтому в последние два десятилетия наблюдается значительный прогресс в изучении молекулярных основ генетики в связи с разработкой разнообразных и эффективных методов генной инженерии. Его кульминацией стали разработка и реализация международного проекта «Геном человека», который имел цель полномасштабное секвенирование, т. е. определение последовательности нуклеотидов, основных кодирующих элементов молекулы наследственности ДНК во всем геноме человека. Его результаты позволили получить и общие представления о том, как организован геном человека и тем самым позволили расшифровать гены ответственные за полиморфизм.
Благодаря исследованиям в области генетики человека и изучению чувствительности к паразитарным заболеваниям выяснилось, что существуют специализированные мутантные аллели, защищающие от тяжелого течения малярии. Малярия является направляющей силой эволюции, которая привела к отсутствию гена Даффи, появлению разных форм гемоглобинопатий (талассемия, серповидно-клеточная анемия и др.), дефицита глюкозо-6-фосфатдегидрогеназы, овалоцитоза и других болезней человечества, обеспечивающих устойчивость к малярии. Широкое распространение ряда генетических аномалий среди населения регионов, высокоэндемичных по малярии, можно рассматривать как результат длительного взаимодействия популяций возбудителей и их хозяев. Наибольшее влияние возбудителей малярии испытали представители негроидной расы, проживающие в тропическом поясе Земли, у которых эта инфекция играла роль основного фактора генетического отбора.
В связи с этим появились генетические варианты, связанные с изменением свойств эритроцитов и обеспечивающие устойчивость к возбудителям малярии:
1. Серповидно-клеточная анемия.
Результат мутации в гене, ответственном за продукцию β-цепи гемоглобина человека, в которой глутамат в позиции 6 оказался замещенным валином, что привело к синтезу аномального гемоглобина S. Гомозиготность является летальной, а гетерозиготность по данному аномальному гену в 90 % случаев защищает от летального исхода тропической малярии.
2. Гемоглобин С.
Результат мутации в гене HbB, при которой глутаминовая кислота или валин заменяются на лизин в 6-м положении. Аллель HbC в гомозиготном состоянии обеспечивает защиту на 90 %, в гетерозиготном — на 30 %. Эта мутация у носителей не сопровождается тяжелыми клиническими проявлениями по сравнению с мутацией HbS.
3. Гемоглобин E.
Является результатом замещения глутамата в позиции 29 β-цепи на лизин. Имеются данные, что эта аномалия может защищать от трехдневной малярии, вызванной P.vivax. Обычно встречается в странах Юго-Восточной Азии, его имеют до 50 % населения.
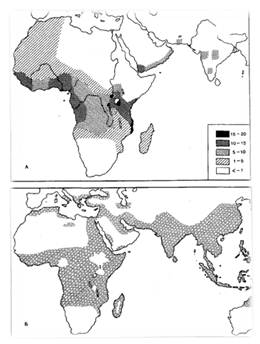
Рисунок 1. Совпадение распространения в Старом Свете аллелясерповидно-клеточной (А) и тропической малярии (Б)
Популяции с высокой частотой встречаемости гемоглобина S распространены практически по всей Африке, за исключением самой южной не малярийной части континента по южному и восточному побережью Средиземного моря, на Аравийском полуострове, Индийском субконтиненте вплоть до восточной границы самого Бангладеша. Таким образом, мы можем легко увидеть прямую зависимость между встречаемостью мутаций и распространением самого плазмодия. Данный факт подтверждает гипотезу, что малярия является движущей силой эволюции.
Дефицит фермента глюкозо-6-фосфатдегидрогеназы.
Ген Г-6-ФДГ локализован в области Хq28-хромосомы. Описано более 300 различных мутаций в этом гене, приводящих к значительному полиморфизму заболеваний. В результате разрушения гемоглобина паразитом, высвобождаются протеиды и железо, участвующие в окислительном процессе, токсичном для плазмодия. Дефицит Г-6-ФДГ способствует окислению, что приводит к снижению частоты тяжелых клинических проявлений тропической малярии у гетерозиготных женщин и гомозиготных мужчин, как в странах Востока, так и в Западной Африке примерно на 50 %. Это одна из распространенных наследственных болезней человека: данную мутацию имеют около 100 миллионов человек в мире.

Рисунок 2. Локализация гена Г-6-ФДГ
Отсутствие гена Даффи.
Наиболее интересной для меня мутацией является отсутствие гена Даффи. Это единственная аномалия, защищающая от малярии и, не вызывающая сложных клинических патологий. Эта мутация делает ее носителей невосприимчивыми к трехдневной малярии, так как P.vivax не могут проникать в эритроциты, не имеющие антигенов Даффи, выполняющие роль рецепторов для плазмодия данного вида. В Западной и Центральной Африке частота такой аномалии составляет 97 %.
В известном научном сообществе National Science Foundation была опубликована уникальная статья под название “Variation in the Same Gene Affects Rate of Parasite Infection in Both Humans and Baboons”, что дословно переводится как, различие влияния одного и того же гена у человека и у бабуина.

Рисунок 3. Параллельная эволюция устойчивости к малярии у приматов
Суть в том, что и бабуины, и человек на протяжении столетий имели схожую эволюционную историю и ареал распространения, восточноафриканские саванны. Параллельность течения эволюции была продемонстрирована путем влияния гена Даффи на устойчивость и восприимчивость к инфекции малярии. Этот механизм хорошо известен в организме человека, когда ген Даффи включен, он создает рецепторы на поверхности красных кровяных клеток, позволяющих малярии внедриться в эритроцит. Когда ген выключен — малярийный плазмодий не может проникнуть в эритроцит. В свою очередь у бабуинов тоже есть определенная связь между генетической изменчивостью и степенью заражения малярией. Когда ген включен, большее количество рецепторов начинают строиться на мембране эритроцитов, но частота инфекции понижается. Когда ген выключен, наоборот. Также стоит отметить схожую с этой мутацией, недостаточность мембранных эритроцитарных белков-гликофоринов A, B, C.Эти белки являются рецепторами для связывания с паразитом. Их генетическая недостаточность делает эритроциты относительно устойчивыми к инвазии P. falciparum. На рисунке проиллюстрировано расположение гликофоринов. Они пронизывают мембрану и являются своего рода каналом проникновения паразита, и при их отсутствии малярийный плазмодий не может проникнуть в эритроцит.

Рисунок 4. Расположение гликофоринов в мембране эритроцитов
Однако, не только мутации способны развить устойчивость к паразитам, но и наличие и распределение определенного гена.
Шистосоматоз.
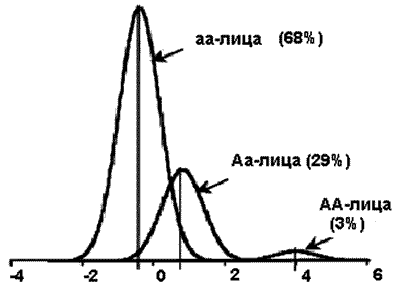
Рисунок 5. Распределение гена, определяющего чувствительность популяции к возбудителю инфекционной болезни. На схеме показана частота аллеля А гена SM1, предрасполагающего к развитию шистосоматоза, среди населения Бразилии [Abel L., Desseint A., 1998]
В исследованиях, проведенных с помощью сегрегационного анализа, показано, что среди населения Бразилии ген SM1 несет ответственность за 66 % случаев тяжелого течения болезни (рис. 5) Приблизительно 3 % бразильцев гомозиготны по этому гену и предрасположены к тяжелым формам течения болезни (АА-лица), 68 % гомозиготны по резистентности шистосоматозу (аа-лица), 29 % гетерозиготны и имеют промежуточный уровень резистентности к паразиту (Аа-лица). Ген SM1 картирован в регионе хромосомы 5q31-q33, ответственном за контроль дифференциации Т-лимфоцитов. Таким образом, можно сделать вывод, что отсутствие гена SM1 обеспечивает резистентность к шистосомозу.
К сожалению, не все рассмотренные примеры можно в настоящее время объяснить. Некоторые известны как эмпирические факты, однако они убеждают в необходимости индивидуальной работы врача с больными, страдающими паразитарными заболеваниями, и делают необходимым дальнейшее изучение факторов восприимчивости человека к паразитам.
Список литературы:
1. Механизмы заражения малярией. Эндемичные очаги малярии — [Электронный ресурс] — Режим доступа. — URL: http://meduniver.com/Medical/Microbiology/1676.html MedUniver.
2. Супотницкий Михаил Васильевич. Микроорганизмы, токсины и эпидемии. Учеб. пособие для вузов / Под ред. М.В. Супотницкого — М.: «Вузовская книга», 2010. — 376 с.
3. Kendall Morgan, Duke University .Variation in the Same Gene Affects Rate of Parasite Infection in Both Humans and Baboons — [Электронный ресурс] — Режим доступа. — URL: http://www.nsf.gov/news/news_summ.jsp?org=NSF&cntn_id=115048&preview=false.





