РАЗРАБОТКА И ВАЛИДАЦИЯ МЕТОДИКИ ОПРЕДЕЛЕНИЯ ТЕРИЗИДОНА В КОМБИНИРОВАННЫХ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТАХ
Секция: 1. Химические науки

XXXII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
РАЗРАБОТКА И ВАЛИДАЦИЯ МЕТОДИКИ ОПРЕДЕЛЕНИЯ ТЕРИЗИДОНА В КОМБИНИРОВАННЫХ ПРОТИВОТУБЕРКУЛЕЗНЫХ ПРЕПАРАТАХ
Туберкулез (ТБ) — это излечимое заболевание, от которого до сих пор ежегодно во всем мире умирает около 1,4 млн человек и которое является основной причиной смертности среди людей, живущих с ВИЧ/СПИД. Из 9,4 млн новых случаев заболевания туберкулезом каждый год 440 тысяч — это пациенты с формами, устойчивыми к нескольким противотуберкулезным препаратам, что означает, что они не поддаются лечению при помощи двух основных антибиотиков, которыми обычно лечится туберкулез. За последние десять лет лекарственно-устойчивый туберкулез (ЛУ-ТБ) развился приблизительно у пяти миллионов человек, однако менее 1% из них имели доступ к адекватному лечению, и полтора миллиона из них погибли [2, с. 15].
Теризидон включен в руководства ВОЗ как бактериостатический препарат второго ряда орального применения Группы 4 — препараты, рекомедованные для лечения лечения активного легочного и внелегочного туберкулеза (включая почечное заболевание), когда вызывающие заболевание организмы чувствительны к этому препарату и когда лечение основными противотуберкулезными препаратами оказалось недостаточным [1, с. 6].
Определение теризидона затруднено тем, что молекула циклосерина обладает высокой полярностью, имеет функциональные группы, которые не чувствительны к ультрафиолетовому поглощению, а также недостаточно стабильна в кислотной среде. Молекула теризидона с течением времени гидролизирует, с образованием двух молекул циклосерина и терефтальдегида [3, с. 37199].
Целью данной работы является разработка быстрой, простой и точной методики определения теризидона в тесте «Растворение» с использованием метода ВЭЖХ, а также сравнение валидационных характеристик предложенной методики по показателям селективности, линейности, правильности, прецизионности.
Методика выполнения анализа.
Испытание проводят в соответствии с требованиями ГФ РК I, т. 2, 2.9.3, используя прибор с корзинкой. Среда растворения – буферный раствор с рН 3.0, объем среды растворения – 500 мл, температура среды растворения – 37 ± 0.5ºС, скорость вращения корзинки – 100 об/мин, время растворения – 45 мин.
Определение проводят методом жидкостной хроматографии (ГФ РК I, т. 1, 2.2.29). Для испытания в корзинку помещают 1 таблетку.
Через 45 мин отбирают 100 мл раствора из центра сосуда для растворения и фильтруют через мембранный фильтр с размером пор 0.45 мкм, отбрасывая первые порции фильтрата.
5.0 мл полученного фильтрата помещают в мерную колбу вместимостью 50 мл, доводят объем раствора буферным раствором с рН 3.0 до метки и перемешивают (испытуемый раствор).
По 20 мкл испытуемого раствора и 20 мкл раствора сравнения попеременно хроматографируют на жидкостном хроматографе с УФ - детектором, получая не менее 5 хроматограмм для каждого из растворов в следующих условиях:
· колонка из нержавеющей стали размером 250 мм x 4.6 мм, заполненная силикагелем октадецилсилильным для хроматографии Р с размером частиц 5 мкм или аналогичная;
· подвижная фаза: ацетонитрил для хроматографии Р1 – буферный раствор с рН 3.0 (20:80), дегазированная любым удобным способом;
· скорость подвижной фазы – 1.2 мл/мин;
· детектирование - при длине волны 285 нм;
· температура колонки - 30оС;
· время хроматографирования - 15 мин.
Содержание протионамида (теризидона) (Х), перешедшего в раствор из таблетки, в процентах, вычисляют по формуле:
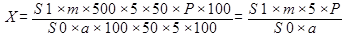 (1)
(1)
где: 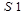 – среднее значение площадей пиков протионамида (теризидона), вычисленное из хроматограмм испытуемого раствора;
– среднее значение площадей пиков протионамида (теризидона), вычисленное из хроматограмм испытуемого раствора;
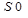 – среднее значение площадей пиков протионамида (теризидона), вычисленное из хроматограмм раствора сравнения;
– среднее значение площадей пиков протионамида (теризидона), вычисленное из хроматограмм раствора сравнения;
 – масса навески стандартного образца (СО) протионамида (теризидона), в миллиграммах;
– масса навески стандартного образца (СО) протионамида (теризидона), в миллиграммах;
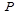 – содержание протионамида (теризидона) в СО протионамида (теризидона), в процентах;
– содержание протионамида (теризидона) в СО протионамида (теризидона), в процентах;
 – содержание протионамида (теризидона), указанное в разделе «Состав на одну таблетку», в миллиграммах.
– содержание протионамида (теризидона), указанное в разделе «Состав на одну таблетку», в миллиграммах.
Приготовление раствора сравнения: 50.0 мг теризидона (СО НД фирмы) и 50 мг протионамида (СО НД фирмы) помещают в мерную колбу вместимостью 100 мл, добавляют 50 мл буферного раствора с рН 3.0, нагревают на водяной бане при температуре 40ºС в течение 20 минут, охлаждают и доводят тем же растворителем до метки, перемешивают и фильтруют через мембранный фильтр с размером пор 0.45 мкм.
5.0 мл полученного раствора помещают в мерную колбу вместимостью 50 мл, доводят до метки буферным раствором с рН 3.0 и перемешивают.
Приготовление буферного раствора с рН 3.0: 0.5 г натрия октаносульфоната растворяют в 800 мл воды, прибавляют 5 мл ледяной уксусной кислоты, прибавляют раствор натрия гидроксида 1М до рН 3.0±0.05, доводят объем раствора водой до 1 литра и перемешивают.
Валидация разработанной методики.
Валидацию методики теста «Растворение» проводили в соответствии с Государственной фармакопеей Республики Казахстан [4, с. 100] по следующим характеристикам: селективность, линейность, диапазон применения, сходимость.
Селективность.
Проводили анализ образцов стандартного раствора теризидона и раствора плацебо. На хроматограммах образцов плацебо не наблюдалось пиков со временем удерживания, соответствующим времени удерживания теризидона. Поскольку проводилось исследование относительно полученного терефтальдегиа, в результате гидролиза теризидона, было указано соответствующее время удерживания пика терефтальдегида. Соответствующие хроматограммы приведены ниже на рисунках 1-3.

Рисунок 1. Хроматограмма раствора плацебо
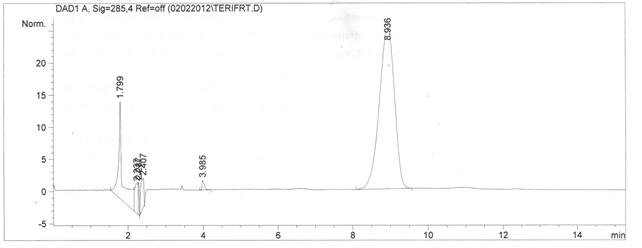
Рисунок 2. Хроматограмма раствора стандартного образца терефтальдегида
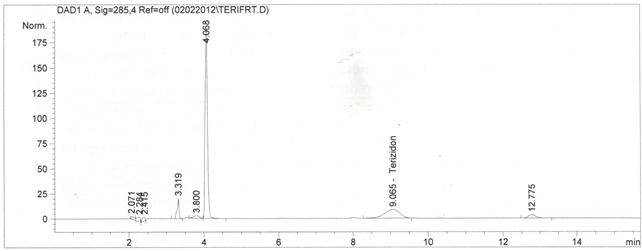
Рисунок 3. Хроматограмма раствора стандартного образца теризидона
Линейность и диапазон применения
Проводили анализ пяти образцов с прибавлением стандартного раствора теризидона до получения следующих концентраций: 0,04 мг/мл, 0,045 мг/мл, 0,05 мг/мл, 0,055 мг/мл, 0,06 мг/мл. По полученным значениям был построен калибровочный график, приведенный на рисунке 4.
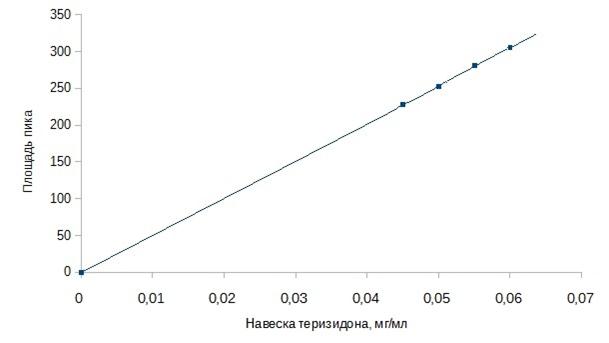
Рисунок 4. Калибровочный график стандартного раствора теризидона
Таблица 1.
Построение калибровочного графика стандартного раствора теризидона
|
С, мг/мл |
0,000 |
0,040 |
0,045 |
0,050 |
0,055 |
0,060 |
|
S пика |
0,00000 |
201,12343 |
230,93066 |
249,61472 |
285,17505 |
295,73154 |
Сходимость.
Степень согласования результатов при анализах однородного образца, выполненных одним аналитиком при одних и тех же условиях (реактивы, оборудование, обстановка и др.), и в течение короткого промежутка времени соответствует критерию приемлемости: не более 2 процентов для 6 измерений.
Таблица 2.
Сходимость результатов
|
№ |
S пика |
|
1 |
288,52576 |
|
2 |
286,25864 |
|
3 |
289,49384 |
|
4 |
286,92462 |
|
5 |
291,12589 |
|
6 |
290,36514 |
|
Среднее значение |
288,78 |
|
Стандартное отклонение |
1,92 |
Заключение.
Разработана методика определения теризидона в комбинации с протионамидом, используемая в тесте «Растворение» с использованием метода ВЭЖХ с УФ-детектированием. Методика показала высокую чувствительность, точность и воспроизводимость. Данная методика может быть использована на стадии клинических и фармакокинетических исследований новых воспроизведенных лекарственных средств теризидона.
Список литературы:
1. Медикаменты для лечения лекарственно-устойчивого туберкулеза под микроскопом / ВОЗ / Март 2011 / С.6.
2. Blanc L, Falzon D, Fitzpatrick C, Floyd K, Garcia I, Gilpin C, et al. Global tuberculosis control: WHO report 2010 / Глобальный контроль над туберкулезом.
3. Patel U., Y.P. Yan, F.W. Hobbs, Jr., J. Kaczmarczyk, A.M. Slee, D.L. Pompliano, M.G. Kurilla, E.V. Bobkova. Oxazolidinones Mechanism of Action: Inhibition of the First Peptide Bond Formation / Vol. 276, № 40, Issue of October 5, Р. 37199–37205, 2001
4. Государственная фармакопея Республики Казахстан / Том 1 / С.100





