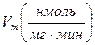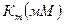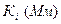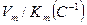ИССЛЕДОВАНИЕ КИНЕТИЧЕСКИХ ХАРАКТЕРИСТИК ЛАКТАТ-ДЕГИДРОГЕНАЗЫ В МОЗГЕ КРЫС ПРИ УМЕРЕННОЙ ГИПОТЕРМИИ
Секция: 2. Биологические науки
лауреатов
участников
лауреатов


участников



XXXIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ИССЛЕДОВАНИЕ КИНЕТИЧЕСКИХ ХАРАКТЕРИСТИК ЛАКТАТ-ДЕГИДРОГЕНАЗЫ В МОЗГЕ КРЫС ПРИ УМЕРЕННОЙ ГИПОТЕРМИИ
Лактатдегидрогеназа (ЛДГ) – это ключевой фермент важнейшего метаболического пути – гликолиза. ЛДГ – это тетрамер, в образовании которого могут служить субъединицы двух типов – М (А) и Н (В). В мозге обнаружены все пять изоформ ЛДГ, причем, в самих нейронах наиболее распространена ЛДГ 1, преимущественно катализирующая обратную реакцию – превращение лактата в пируват, а в астроцитах ЛДГ5, катализирущая прямую реакцию – превращение пирувата в лактат [4]. Высокая каталитическая эффективность ЛДГ является основным условием рециркуляции гликолитического потока в анаэробных условиях [3]. Гликолиз – это эволюционно древний энергетический механизм генерации аденозинтрифосфота [5]. Несмотря на то, что накопление свободного кислорода в биосфере способствовало появлению энергетически более выгодного пути синтеза АТФ – окислительного фосфорилирования, гликолитические ферменты играли и продолжают играть важную роль не только у облигатных и факультативных анаэробов, но и у строгих аэробных организмов при дефиците кислорода (гипоксии) в тканях.
Одним из множества физических факторов, вызывающих гипоксию, являются низкие температуры окружающей среды, которые могут привести к снижению температуры тела – гипотермии [1]. В настоящее время гипотермические состояния животных представляют большой теоретический интерес, так как позволяют оценить адаптивные возможности организма в условиях экстремального температурного режима. Кроме того, они нашли широкое применение в медицине при операциях на сердце и мозге.
Гомойотермия – это эволюционно молодая стратегия адаптации, направленная на поддержание постоянной температуры тела за счет терморегуляторных механизмов. Эндогенное термостатирование организма открыло новые функциональные возможности для выживания гомойотермов. Однако при некотором критическом значении температуры окружающей среды терморегуляторные механизмы могут не справиться со своими функциями. Температура тела при этом значительно снижается, что приводит к уменьшению кровоснабжения тканей и как следствие к гипоксии в них. Это требует ответной реакции со стороны ферментов, играющих важную роль в энергообеспечении клетки. Возможно, что в экстремальных условиях у них могут проявиться филогенетически древние механизмы адаптаций, направленные на компенсацию активности ферментов [2]. Насколько эффективны температурные компенсации у гомойотемов – вопрос открытый?
Материалы и методы исследования
Исследования проводили на белых беспородных крысах (обоих полов) массой 150-200 г. Гипотермическое состояние создавали, помещая животных в камеру, в рубашке которой циркулировала вода с температурой 4–6 ºС. Состояние умеренной гипотермии достигалось за 25–30 минут. Животных декапитировали, выделяли мозг. Навеску ткани (1–2 г) измельчали и гомогенизировали с 4-мя объёмами 0,1 М фосфатного буфера (рН 7,4). Гомогенат центрифугировали при 600 g в течение 10 мин. Центрифугат, профильтрованный через 4 слоя марли, повторно центрифугировали при 15000 g в течение 10 мин. Полученный супернатант хранили в холодильнике при 4°С.
Активность ЛДГ определена спектрофотометрически, по убыли содержания НАДН в реакционной среде. Концентрационная зависимость активности определена в диапазоне концентраций пирувата 0,01–25 мМ. Кинетические характеристики (константа ингибирования(Ki), максимальная скорость (Vm) и константа Михаэлиса (Km) определены методом наименьших квадратов, используя пакет СТАТИСТИКА. В опции «нелинейное оценивание» применялось уравнение Холдейна.
Статистическую обработку результатов вели с использованием пакета СТАТИСТИКА. Достоверность различия определяли с помощью критерия Стьюдента на уровне значимости P=0,05. Каждая кривая на графиках концентрационной зависимости скорости окисления НАДН – среднее 8-ми независимых экспериментов. Данные в таблице приведены в виде: среднее ± ошибка среднего.
Результаты и обсуждение
Была исследована концентрационная зависимость мозга крыс при гипотермии 30°С. Результаты исследования представлены на таблице 1 и рис 1, 2. Оказалось, что для ЛДГ мозга имеет место субстратное ингибирование.
При умеренной гипотермии наблюдается существенное повышение активности ЛДГ. Так, например, при концентрации пирувата 1,6 мМ скорость катализа увеличивается на 52,6%. При этом оптимум на концентрационной кривой сдвигается в сторону более высоких концентраций пирувата. Особенно ярко выражено изменение активности фермента при низких концентрациях пирувата.
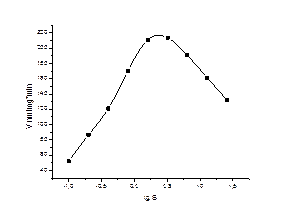
Рисунок 1. Концентрационная зависимость ЛДГ мозга крыс (контроль)
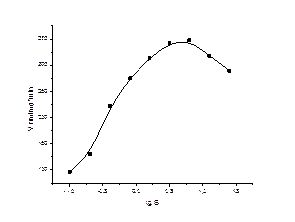
Рисунок 2. Концентрационная зависимость ЛДГ мозга крыс при умеренной (30° С) гипотермия
Исследование кинетических характеристик ЛДГ мозга крыс показало, что гипотермия 30°С сопровождается значительным повышением Vmax (в 1,5 раза) (табл. 2). При этом значение Km не претерпевает изменений, поэтому в целом эффективность катализа значительно растет. Умеренная гипотермия приводит к значительному повышению Ki (≈ в 3 раза), что свидетельствует об уменьшении скорости образования ковалентного аддукта между пируватом и ЛДГ.
Таблица 1.
Кинетические характеристики ЛДГ головного мозга крыс в норме и при умеренной гипотермии
|
Состояние животного |
|
|
|
|
Sопт |
∆=Кi-Кm |
|
контроль |
263,23 ±7,05 |
0,399 ±0,020 |
23,71 ±2,19 |
658,40 ±25,61 |
3,07 ±0,09 |
23,31
|
|
гипотермия 30°С |
392,04 ±10,18 р1,2<0,05 |
0,338 ±0,028 р1,2<0,05 |
71,81 ±12,33 р1,2<0,05 |
1159,91 ±42,23 р1,2<0,001 |
4,92 ±0,07 р1,2<0,05 |
71,47
|
Таким образом, исследование показало, что при умеренной гипотермии происходит значительное повышение каталитической эффективности ЛДГ в мозге. Как известно, гипотермия 30°С сопровождается резким ухудшением кровотока в мозге и, как следствие, гипоксией. В этих условиях нейроны вынуждены выбрать энергетически менее выгодный путь окисления глюкозы – анаэробное окисление. Поэтому повышение активности ЛДГ при умеренной гипотермии направлено на интенсификацию анаэробного гликолиза, как единственного источника энергии. Смешение позиции оптимума на графике концентрационной зависимости и повышение Ki указывает на достаточно эффективный катализ при высоких (ингибирующих) концентрациях пирувата.
Обнаруженные нами изменения в кинетических характеристиках ЛДГ, скорее всего, несут адаптивный характер и направлены на поддержание ритмической активности нейронов в мозге при низких температурах тела. Исследование показало, что эффективность катализа ЛДГ изменяется в основном за счет Vmax, что указывает на увеличение либо концентрации фермента, либо константы скорости образования продуктов реакции (k2). Поскольку в условиях существенного энергодефицита вряд ли можно ожидать синтеза новых молекул фермента, скорее всего скорость увеличивается за счет k2. Одно из возможных причин изменения k2 может быть модификация структуры фермента. В работе было показано, что такая модификация может быть вызвана фосфорилированием или дефосфорилированием ЛДГ(Storey K.B., 2012).
Список литературы:
1. Озернюк Н.Д. // Температурные адаптации. М: Н.Д. – 2000. C. 210.
2. Халилов Р. А., Джафарова А. М., Мейланов И. С. // Известия ВУЗов Северо-Кавказский регион. Естественные науки. 2011. В.1. С. 75–78.
3. Fields P.A., Kim Y.-S., Carpenter J.F., Somero G.N. // J. Exp. Biol. – 2002. V.205. P. 1293–1303.
4. O’Brien J., Kla K. M., Hopkins I. B., Malecki E. A. and McKenna M. C. // Neurochem Res. 2007. V. 32. P. 597–607.
5. Webster K. A. // The Jour. of Exper-l Biology. 2003. V. 206. P. 2911–2922.
6. Xiong Z. J., Storey K.B. // Comparative Biochemistry and Physiology, Part B. 2012. V. 163. P. 221–228.