ВЛИЯНИЕ 1H–БЕНЗИМИДАЗОЛ–1–ИЛ–МЕТАНОЛА НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ СЕРДЦА КРЫСЫ
Журнал: Научный журнал «Студенческий форум» выпуск №22(245)
Рубрика: Биология

Научный журнал «Студенческий форум» выпуск №22(245)
ВЛИЯНИЕ 1H–БЕНЗИМИДАЗОЛ–1–ИЛ–МЕТАНОЛА НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ СЕРДЦА КРЫСЫ
Сбои в сердечной деятельности влекут за собой серьёзные последствия для всего организма в целом. Для лечения сердечно-сосудистых заболеваний применяются различные лекарственные препараты и постоянно осуществляется разработка новых. Одним из возможных кандидатов на роль такого препарата является 1H–бензимидазол–1–ил –метанол, который является химическим производным имидазола и синтезирован на кафедре органической химии Самарского национального исследовательского университета им. академика С. П. Королёва. Данные по кардиотропному влиянию производных бензимидазолов очень немногочисленны.
Имидазол представляет собой пятичленный гетероциклический фрагмент, содержащий три атома углерода, два атома азота, четыре атома водорода и две двойные связи. Он также известен как 1,3-диазол [1, 2].
Имидазолы обладают широким спектром биологической активности, включая противоопухолевую, противогрибковую, противовирусную, антибактериальную и др. Среди различных гетероциклических соединений имидазол более известен благодаря широкому диапазону химических и биологических свойств [3, 4].
Также они используются в качестве лекарственных препаратов при лечении патологий центральной нервной системы, в том числе болезни Альцгеймера, являются антагонистами опухолевого роста, стресс-протекторами, используются при лечении сердечно-сосудистых заболеваний, обладают противомикробной активностью и многими другими видами биологической активности (БА) [5].
Многие исследовательские работы показали, что имидазолы обладают потенциалом противоопухолевых препаратов. Успех имидазолов в качестве противоопухолевых средств начался с дакарбазина, что вызвало интерес к разработке имидазольных средств. Противораковые препараты на основе имидазола обладают значительным потенциалом из-за их способности сначала вмешиваться в синтез ДНК, а затем останавливать рост и деление клеток. До сих пор использовались многие противоопухолевые препараты на основе имидазола: азатиоприн, мизонидазол, пимонидазол, нилотиниб, дакарбазин и др.
Дакарбазин - это алкилирующий агент, который разрушает раковые клетки путем добавления алкильной группы к ДНК. Он применяется при метастатической злокачественной меланоме, лимфоме Ходжкина, саркоме и островково-клеточной карциноме поджелудочной железы [6, 7, 8].
Исследования по поиску противораковых препаратов на основе имидазола продолжается до сих пор, однако ученые прогнозируют довольно крупные перспективы в лечении рака.
Если говорить о наиболее известных производных на основе имидазола, то широкую известность приобрели бензимидазолы. Производные бензимидазола влияют на нервную систему в зависимости от дозировки вещества и проявляются на разных уровнях организации: молекулярном, клеточном и др. [9].
На кровеносную систему производные бензимидазола воздействуют следующим образом: они действуют на патогенетические звенья тромбоцитов и коагуляционный гемостаз. Среди них найдены соединения, играющие важную роль как в процессах свертывания крови и восстановления поврежденных кровеносных сосудов, так и активирующие противосвертывающую систему [10].
Четких представлений о биохимических механизмах влияния бензимидазола на миокард до настоящего времени нет.
Таким образом, можно заметить, что многие физиологические эффекты имидазола известны очень давно и в настоящее время во многих странах перешли к клиническим испытаниям имидазола и его производных.
Условия и методы исследования
Исследования проводили в хронических опытах на 18 нелинейных половозрелых самцах крыс массой 200 – 250 г., наркотизированных уретаном. Животных делили на 3 опытных группы по 6 животных в каждой.
У всех животных регистрировали электрокардиограмму (ЭКГ) на фоне действия исследуемого соединения через 5, 10, 15, 20, 25, 30, 35, 40 и 45 минут. С целью исследования зависимости «доза – эффект» применяли широкий диапазон концентраций вещества от 10-2 до 10-6М. Растворы вещества вводили внутрибрюшинно в объеме 1 мл.
В экспериментах определялось влияние вещества на основные параметры ЭКГ: продолжительность зубца P, интервалов R-R, Р-Q, Q-T и комплекса QRS, а также частоту сердечных сокращений (ЧСС).
Запись ЭКГ проводили на электрокардиографе Альтон – 03М2 при помощи стальных игольчатых электродов во втором стандартном отведении.
По динамике колебаний временных и амплитудных параметров кривой электрической активности сердечной мышцы судили о кардиотропных свойствах исследуемого соединения.
Результаты экспериментов были подвергнуты статистической обработке с применением критерия Стьюдента. Все данные представлены как средние значения ± стандартные ошибки. Для построения графиков был использован программный пакет SigmaPlot. Статистически значимыми считались изменения со значениями: * – р<0,05; ** – р<0,01; *** – р<0,001.
Результаты и их обсуждение
Анализ ЭКГ, зарегистрированных после внутрибрюшинных инъекций исследуемого вещества, позволил выявить характерные изменения их паттерна.
На рисунке 1 показаны изменения частоты сердечных сокращений.
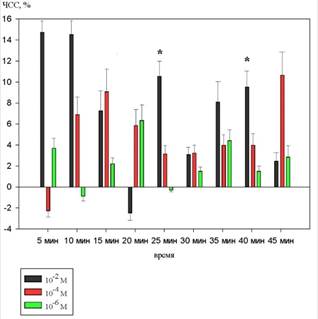
Рисунок 1 Динамика изменений частоты сердечных сокращений на фоне действия 10-2 М, 10-4 М и 10-6 М растворов 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня)
При введении 10-2 М раствора 1H–бензимидазол–1–ил–метанола ЧСС имела тенденцию к увеличению, , однако, статистически значимые изменения были зарегистрированы только на 25 и 40 минутах и составили 11,1±2,1% (p<0,05), 9,2±1,9% (p<0,05) соответственно.
На фоне действия 10-4 М и 10-6 М растворов статистически значимых изменений не выявлено.
На рисунке 2 показаны изменения продолжительности интервала R-R.
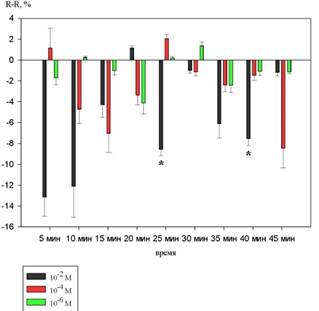
Рисунок 2. Динамика изменений интервала R-R на фоне действия 10-2 М, 10-4 М и 10-6 М растворов 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня)
При введении 1H–бензимидазол–1–ил–метанола в концентрации10-2 М интервал R-R уменьшался. Статистически значимые изменения наблюдались на 25 и 40 минутах и составили 9,4±2,5% (p<0,05), 7,6±2,2% (p<0,05) соответственно.
На фоне действия 10-4 М и 10-6 М растворов статистически значимых изменений не обнаружено.
На рисунке 3 показаны изменения продолжительности интервала P-Q.
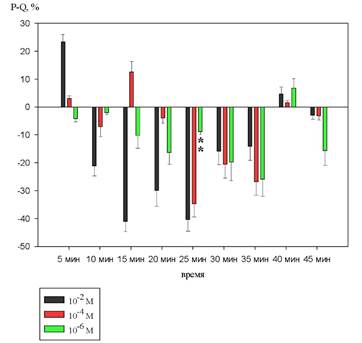
Рисунок 3. Динамика изменений интервала P-Q на фоне действия 10-2 М, 10-4 М и 10-6 М растворов 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня)
На фоне действия 10-2 М и 10-4 М растворов 1H–бензимидазол–1–ил–метанола статистически значимых изменений не выявлено.
При введении вещества в концентрации 10-6 М интервал P-Q имел тенденцию к уменьшению, однако статистически значимых изменений достиг только на 25 минуте и составил 9,8±45,2% (p<0,01) по сравнению с исходным уровнем.
На рисунке 4 показаны изменения продолжительности интервала Q-T.
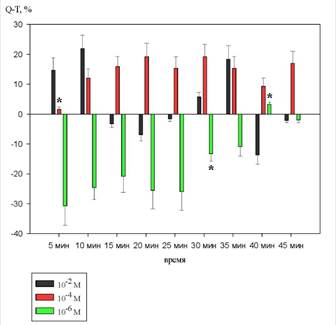
Рисунок 4. Динамика изменений интервала Q-T на фоне действия 10-2 М, 10-4 М и 10-6 М растворов 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня)
На фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола статистически значимых изменений не выявлено.
При введении 10-4 М раствора 1H–бензимидазол–1–ил–метанола, статистически значимое увеличение наблюдалось 5 минуте и составило 2,2 ±1,7% (p<0,05).
При введении вещества в концентрации 10-6 М статистически значимое уменьшение данного параметра наблюдалось на 30 и увеличение на 40 минуте. Изменения составили соответственно 15,5±6,2% (p<0,05) и 4,2±2,6% (p<0,05).
На рисунке 5 показаны изменения продолжительности зубца P.
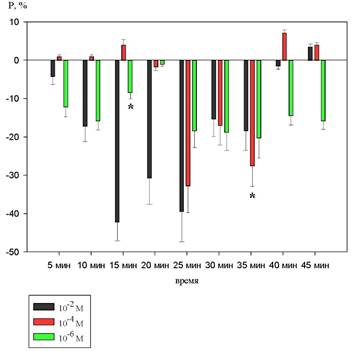
Рисунок 5. Динамика изменений продолжительности зубца Р на фоне действия 10-2 М, 10-4 М и 10-6 М растворов 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня)
При введении вещества в концентрации 10-2 М продолжительность зубца Р не достигала статистически значимых изменений.
При введении 10-4 М раствора 1H–бензимидазол–1–ил–метанола статистически значимое уменьшение наблюдалось на 35 минуте и составило 28,4±10,2% (p<0,05).
На фоне действия 10-6 М раствора 1H–бензимидазол–1–ил–метанола продолжительность зубца Р также уменьшалась. Изменения достигли статистически значимых изменений на 15 минуте и составили 8,3±14,4% (p<0,05).
На рисунке 6 показаны изменения продолжительности комплекса QRS.
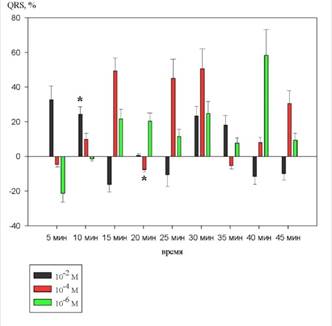
Рисунок 6. Динамика изменений комплекса QRS на фоне действия 10-2 М, 10-4 М и 10-6 М растворов 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня)
На фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола продолжительность комплекса QRS имела тенденцию к увеличению и достигла статистически значимых изменений на 10 минуте, которые составили 26,9±19,4% (p<0,05).
При введении вещества в концентрации 10-4 М на 20 минуте отмечалось статистически значимое уменьшение данного параметра. Изменения составили 14,9±5,1% (p<0,05).
При введении 10-6 М раствора 1H–бензимидазол–1–ил–метанола продолжительность комплекса QRS статистически значимых изменений не достигала.
Обсуждение полученных результатов
Проанализировав экспериментальные данные, полученные при изучении влияния 1H–бензимидазол–1–ил–метанола на функциональное состояние сердца крыс, мы выявили изменения основных параметров ЭКГ.
Длительность желудочкового комплекса QRS, отражающего стадию реполяризации предсердий и проведение импульсов по правой и левой ножкам пучка Гисса, претерпевала изменения как в сторону увеличения, так и уменьшения. Сложный характер изменений этого комплекса связан с тем, что охват возбуждением желудочков осуществляется посредством последовательной передачи возбуждения по элементам проводящей системы сердца.
При введении исследуемого соединения в концентрации 10-2 М наблюдалась тенденция к увеличению частоты сердечных сокращений и уменьшение интервала R-R, который отражает продолжительность сердечного цикла. Это свидетельствует о развивающейся на фоне действия вещества тахикардии. При инъекции вещества в концентрации 10-6 М интервал P-Q уменьшался. Укорочение интервала P-Q означает задержку проведения импульса или свидетельствует о синдроме Вольфа-Паркинсона-Уайта (синдром WPW). Тенденция учащения ЧСС в сочетании с уменьшением продолжительности интервала P-Q может свидетельствовать о развитии синусовой тахикардии.
При этой же концентрации происходило уменьшение продолжительности интервала Q-T и зубца Р.
Подводя итог всему вышесказанному, можно заключить, что 1H–бензимидазол–1–ил–метанол оказывает негативное влияние на функциональное состояние сердца крыс, изменяя течение в нем электрических процессов. Довольно сложно говорить о возможных механизмах вмешательства данного соединения в деятельность сердца в условиях целостного организма. Весьма вероятно, что реакция сердечно-сосудистой системы на введение исследуемого соединения является интегративным ответом как на его прямое действие на сократительный миокард и проводящую систему сердца, так и на опосредованное - через рефлекторные и гуморальные механизмы влияния на сердце и сосуды.
Выявленные у исследуемого соединения эффекты не дают возможности делать чёткие прогнозы о возможности использования его для фармакотерапевтической коррекции различных нарушений деятельности сердечно - сосудистой системы. Дальнейшее исследование по синтезу фармацевтических препаратов с предполагаемыми кардиотропными свойствами должно вестись в направлении уменьшения их повреждающего действия на миокард и проводящую систему сердца.
Заключение
Таким образом, в данном исследовании было продемонстрировано, что 1H–бензимидазол–1–ил–метанол оказывает преимущественно негативное влияние на функциональное состояние сердца крыс, на что указывают характерные изменения параметров электрокардиограммы.

