Физические свойства стали и титана, как материалов костных фиксаторов
Журнал: Научный журнал «Студенческий форум» выпуск №8(29)
Рубрика: Медицина и фармацевтика

Научный журнал «Студенческий форум» выпуск №8(29)
Физические свойства стали и титана, как материалов костных фиксаторов
Введение
Материалом выбора для внутренней фиксации на сегодняшний день остается металл, который обеспечивает высокую жесткость и прочность, достаточную пластичность и обычно хорошо переносится биологически.
Металлические имплантаты производят из нержавеющей стали (НС), технически чистого титана (Ti) или сплавов титана. В последнее время в особых случаях стали применять титан-молибден. Также используют керамику, полимеры, углеродные композиты и биодеградируемые материалы, хотя их применение ограничено в основном специальными показаниями [1].
Материалы имплантатов для внутренней фиксации должны отвечать базовым требованиям, наиболее важными из которых являются надежное функционирование и минимальные побочные эффекты; к следующим по значимости относится легкость в обращении.
Свойства материала
1) Жесткость
Жесткость - это способность материала противодействовать деформации, она измеряется как соотношение приложенной силы и возникающей эластической деформации. Присущая материалу жесткость определяется как модуль его эластичности. Жесткость имплантата зависит от модуля эластичности материала, а также от формы и размеров самого имплантата. Например, модуль эластичности Ti равен примерно половине модуля эластичности (НС); следовательно, при сходных нагрузках Ti будет деформироваться в два раза сильнее, чем сталь (рис. 1). Размеры имплантата влияют на жесткость, поэтому увеличение толщины стандартной пластины из Ti на несколько десятых миллиметра увеличит ее жесткость на сгибание. [2]
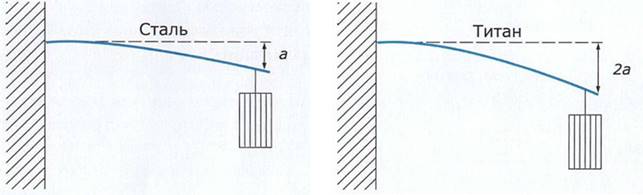
Рисунок 1. Деформация титана и стали под одинаковой нагрузкой
2) Прочность
Прочность - это способность материала противостоять нагрузкам, не подвергаясь деформации. Прочность определяет величину нагрузки, которую может выдержать имплантат. Прежде чем произойдет разрыв, металл может необратимо деформироваться (т.н. пластическая деформация), поэтому размеры имплантата часто более важны, чем прочность материала. Прочность Ti примерно на 10% меньше, чем прочность стали (таб. 1), но увеличение толщины имплантата будет компенсировать различия в прочности материала. Прочность определяет предел нагрузки (силы на единицу площади), которая приводит к деформации. [3]
Для внутренней фиксации критическое значение имеет устойчивость имплантата к повторяющимся нагрузкам, которые могут приводить к усталостным повреждениям. По сравнению со сталью Ti несколько менее устойчив однократны нагрузкам, но лучше переносит действие циклических повторяемых нагрузок [4].
Таблица 1.
Прочность материалов, применяемых для производства винтов

3) Пластичность
Пластичность материала - это степень пластической деформации, которую он выдерживает до возникновения разрыва. Пластичность материала определяет степень, до которой имплантат, например, пластина, может быть контурирован. Как правило, материалы с высокой прочностью, такие как сплавы титана или чистый холоднообработанный Ti, имеют меньшую пластичность, чем сталь. Пластичность дает возможность некоторое время выдерживать деформацию (обеспечивает предупреждение), например, при введении винта. [5]
4) Устойчивость к коррозии
Коррозия - это электрохимический процесс, который приводит к деструкции металла вследствие высвобождения его ионов. Коррозия различна у имплантатов, состоящих из одного компонента, и у имплантатов, представляющих собой систему из нескольких компонентов. Нержавеющая сталь и Ti в виде одного элемента (напр. только пластина или только винт, а не их сочетание) при тестировании демонстрируют высокую устойчивость к коррозии даже в агрессивной среде жидкостей организма человека. Это объясняется формированием защитного пассивирующего слоя на их поверхности. Титан и титановые сплавы обладают очень высокой химической инертностью. На них образуется оксидный пассивирующий слой, который значительно устойчивее к коррозии и термодинамически стабильнее, чем слой оксида хрома на нержавеющей стали. Титановый пассивирующий слой формируется очень быстро и является электрически изолирующим, поэтому имплантат практически не подвергается коррозии. [6]
5) Структура поверхности
При установке имплантата в организм, адсорбция протеинов и адгезия клеток происходят в течение нескольких минут, после чего наблюдается либо адгезия мягких тканей, либо адгезия матрикса вплоть до минерализации [7]. В случае отсутствия адсорбции протеинов и адгезии клеток при наличии микроподвижности происходит формирование фиброзной капсулы.
Исследования на кроликах in vivo показали, что простая модификация поверхности стальной фиксирующей пластины, создание шероховатости, индуцирует большее образование кости в направлении поверхности имплантата без формирования фиброзной ткани между ними. Эти результаты подтверждают гипотезу о том, что на поверхности имплантатов, имеющих выступающие неровности, костная интеграция увеличивается.
Подвижность между мягкими тканями и поверхностью имплантированной пластины может вызывать формирование фиброзной капсулы, окружающей заполненное жидкостью пространство на поверхности раздела. Данное пространство не васкуляризовано, что предрасполагает к развитию инфекции из-за отсутствия мобильных механизмов клеточной защиты.
Согласно клиническим наблюдениям формирование фиброзной капсулы более выражено при использовании стандартных пластин из нержавеющей стали, чем из Ti.
6) Совместимость с магнитно-резонансной томографией (МРТ)
Одобренные АО имплантаты из cpTi являются полностью амагнитными, и выполнение магнитно-резонансной томографии (МРТ) у пациентов с такими имплантатами не представляет никаких сложностей [8]. Эти имплантаты вызывают меньше артефактов по сравнению с имплантатами из нержавеющей стали, в том числе тали с низким содержанием никеля. Одобренные АО имплантаты из нержавеющей стали марки 316L классифицируются как парамагнитные или неферромагнитные. У пациентов с такими имплантатами выполнение МРТ безопасно [8].
Термином «MPT-безопасный» обозначают оборудование, которое может быть использовано внутри или около МР-сканнера без риска для пациентов, но с возможным влиянием на качество изображения.
Термином «МРТ-совместимый» обозначают оборудование, которое и безопасно, и не влияет на диагностическую информацию. Внешние фиксирующие устройства могут содержать магнитные детали и противопоказаны для МРТ.

