Экспериментальная апробация методик определения примесей нитрозаминов в фармацевтических субстанциях валсартана, лозартана и ирбесартана
Секция: Медицина и фармацевтика

XXXIV Студенческая международная научно-практическая конференция «Естественные и медицинские науки. Студенческий научный форум»
Экспериментальная апробация методик определения примесей нитрозаминов в фармацевтических субстанциях валсартана, лозартана и ирбесартана
Введение
В 2018 году в лекарственных препаратах валсартана было обнаружено содержание неидентифицируемого компонента. Проведенные исследования установили принадлежность обнаруженных соединений к классу потенциально генотоксичных примесей нитрозаминов [1].
Обнаружение примесей нитрозаминов в лекарственных препаратах валсартана повлекло за собой ряд исследований, направленных на изучение и разработку методик определения этих соединений при проведении рутинного контроля качества. Было установлено, что методики, часто применяемые в рутинном контроле качества лекарственных средств (ЛС) не обладают достаточной чувствительностью и селективностью для определения примесей нитрозаминов [2].
Решением проблемы недостаточной чувствительности методик определения нитрозаминов является использование методов масс-спектрометрического детектирования. На официальном сайте FDA были опубликованы методики ГХ-МС, основанные на использовании масс-спектрометрического детектирования [3].
Целью данной работы являлась экспериментальная апробация основных существующих методик определения примесей нитрозаминов в лекарственных средствах валсартана, лозартана и ирбесартана.
Материалы и методы
Методика ГХ-МС (прямой ввод)
Определение примесей НДМА, НДЕА методом ГХ-МС (прямой ввод) проводили на приборе Agilent 7890A (детектор MSD 5975С). Колонка – Agilent HP-InnoWAX 30m, 0.32 mm, 0.5 мкм.
Условия хроматографического разделения и приготовления растворов описаны на официальном сайте FDA [4].
Методика ГХ-МС (Headspace)
Определение примесей НДМА, НДЕА методом ГХ-МС (Headspace) проводили на приборе Agilent 7890A (детектор MSD 5975C), с использованием парофазного пробоотборник Agilent HS7694E. Колонка – Agilent DB-1701, 30м, 025мм, 1мкм.
Условия хроматографического разделения и приготовления растворов описаны на официальном сайте FDA [5].
Результаты и обсуждение
Методика ГХ-МС прямой ввод отличается простотой выполнения, а также отсутствием необходимости использования парофазного пробоотборника.
Первым этапом оценки методики ГХ-МС (прямой ввод) являлось подтверждение условий хроматографического разделения и отработка параметров масс-спектрометрического детектирования. Исследования проводились на стандартном растворе нитрозаминов (НДМА, НДЕА) с концентрацией 1 мкг/мл. Характеристичные ионы указанных соединений соответствовали заявленным.
Следующим этапом оценки являлось определение специфичности и предела количественного определения апробируемой методики. Специфичность методики оценивалась анализом модельной смеси с концентрацией нитрозаминов на уровне LOQ (предел количественного определения). Основными критериями приемлемости методики по показателю специфичность являлось отсутствие посторонних пиков в месте выхода нитрозаминов. Хроматограмма модельной смеси нитрозаминов с концентрацией нитрозаминов 0,03 мкг/мл представлены на рис.1.
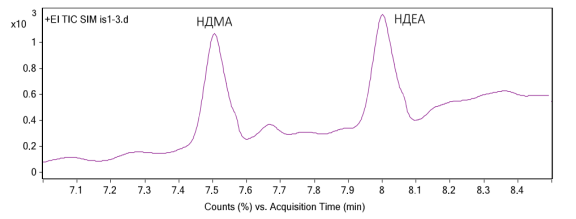
Рисунок 1. Хроматограмма модельной смеси с концентрацией нитрозаминов 0,03 мкг/мл.
Высокая концентрация фармацевтической субстанции не влияет на показатель специфичности методики, однако приводит к приостановке анализа из-за необходимости промывки шприца инжектора, а также замены септы и лайнера. Помимо этого, даже после длительных процедур очистки хроматографической колонки, на хроматограммах оставались пики фармацевтических субстанций.
Апробация методики ГХ-МС (headspace) также состояла из нескольких этапов. На первом этапе проводилась отработка условий хроматографического разделения, а также проверка параметров масс-спектрометрического детектирования.
Следующим этапом оценки методики являлось определение специфичности и предела количественного определения. Специфичность методики соответствовала всем критериям приемлемости, в то время как предел количественного определения был значительно ниже требуемого. На рис.2 изображена хроматограмма модельной смеси с концентрацией нитрозаминов 1 мкг/мл.
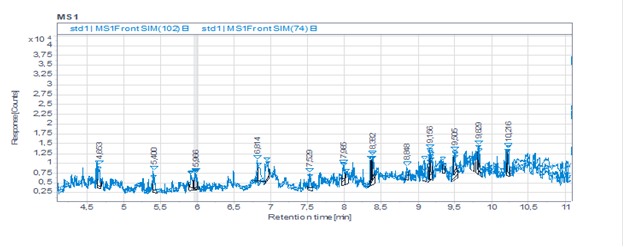
Рисунок 2. Хроматограмма модельной смеси с концентрацией нитрозаминов 1 мкг/мл.
На рис.2. видно, что методика ГХ-МС (headspace) не обладает требуемой чувствительностью. Нами была проведена доработка методики с использованием временных интервалов. На рис 3. Изображена хроматограмма модельной смеси фармацевтической субстанции с концентрацией нитрозаминов 0,15 мкг/мл.
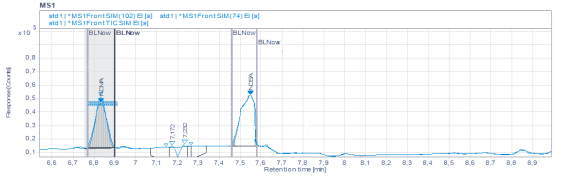
Рисунок 3. Хроматограмма модельной смеси с концентрацией нитрозаминов 0,15 мкг/мл.
Доработанная методика ГХ-МС (headspace) обладает достаточной чувствительностью и соотвествует всем критериям приемлемости по показателю специфичность.
Выводы
Проведенная экспериментальная апробация методик определения примесей нитрозаминов с использованием метода ГХ-МС продемонстрировала возможность использования данной методики в рутинном контроле качества лекарственных средств.
Тем не менее, следует отметить, что использованием методики ГХ-МС требует постоянной замены расходных компонентов, методика ГХ-МС (headspace) соответствует критериям приемлемости только при использовании временных переходов.





