ЭКЗОГЕННЫЕ И ГЕНЕТИЧЕСКИЕ ФАКТОРЫ РАЗВИТИЯ САХАРНОГО ДИАБЕТА
Секция: 2. Биологические науки

XXIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ЭКЗОГЕННЫЕ И ГЕНЕТИЧЕСКИЕ ФАКТОРЫ РАЗВИТИЯ САХАРНОГО ДИАБЕТА
Вступление.
Сахарный диабет — гетерогенная группа метаболических заболеваний, характеризуемая стойким состоянием гипергликемии.
Две формы сахарного диабета являются наиболее распространенными: Диабет первого типа (СД1, ранее известный как инсулинозависимый диабет, ювениальный диабет) и Диабет второго типа (CД2, ранее известный как инсулиннезависимый диабет) — оба вызваны сочетанием генетических и экологических факторов риска. Тем не менее, есть и другие, более редкие, формы диабета, что передаются наследственно. Они включают в себя сахарный диабет взрослого типа у молодых, известный так же как диабет — MODY (сокр. от англ. Maturity onset diabetes of the young) и диабет, связанный с мутацией митохондриальной ДНК.
Все формы сахарного диабета имеют серьезные последствия для здоровья, обусловленные нарушением метаболизма глюкозы (например, гликозилирование белков или гиперлипедимии). Существует целый ряд долгосрочных осложнений, возникающих вследствие специфических диабетических поражений микрососудов.
Сахарный диабет 1 ТипаЭпидемиология. СД1 вызван аутоиммунным разрушением β-клеток островков Лангерганса поджелудочной железы и составляет, примерно, 10 % всех случаев с сахарным диабетом. В настоящее время, пожизненная инсулинотерапия — единственный метод лечения этого заболевания. Без экзогенных инъекций инсулина, люди с СД1 не выживают. Было подсчитано, что свыше 20 миллионов человек во всем мире, в основном дети и подростки, имеют СД1 (ист. Holt. 2004), при этом рост заболеваемости увеличивается на 3—4 % ежегодно (ист. Onkamo и др. 2000).
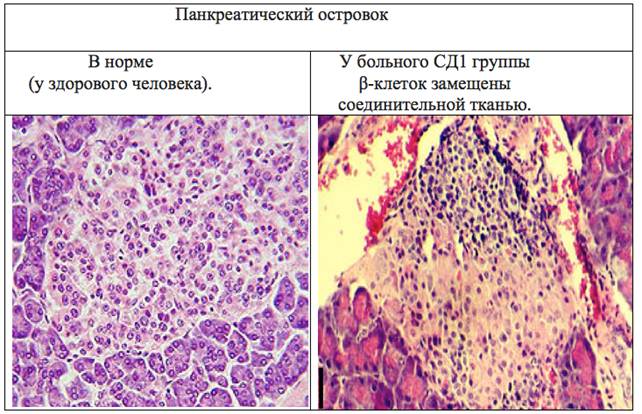
Рисунок 1. Панкреатический островок
Внешние и экологические факторы способствуют этиологии СД1. Это утверждение основано на исследованиях сезонной заболеваемости СД1 во многих странах, где показатель заболеваемости был ниже в течение теплых месяцев и увеличивался во время холодной зимы (Dorman и др., 2003). В частности, недавний рост заболеваемости СД1 так же может быть связан с изменением глобальной окружающей среды, а не с изменениями генофонда, поскольку для этого потребовалась бы смена нескольких поколений. Исследования близнецов так же позволили предоставить доказательства роли экологических факторов риска для СД1. Значения конкордантности по СД1 для монозиготных близнецов значительно выше, чем для дизиготных близнецов (приблизительно 30 % против 10 % соответственно). Тем не менее, большинство монозиготных пар близнецов являются дискордантными. Таким образом, заболевание не может определяться лишь генетически.
Считается, что факторы окружающей среды действуют либо как «инициаторы», либо же в роли «ускорителей» для лиц, имеющих признаки аутоимунного разрушения β-клеток. Так же влияние может быть оказано с помощью механизмов, которые непосредственно или косвенно провоцируют аномальный иммунный ответ на присутствующие в клетках белки.
Наибольшее внимание получили риски окружающей среды, связанные с вирусами (вирус Коксаки) и детским питанием, точнее его составляющими, способными оказать косвенное влияние на развитие заболевания. Питание играет немаловажную роль в этиологии СД1, так ученой группой Borch-Johnsen et al было отмечено влияние длительности грудного вскармливания на степень иммунологической защиты. Сокращение продолжительности грудного вскармливания способно косвенно отражать раннее воздействие пищевых белков, стимулирующих аномальный ненормальную иммунную реакцию у новорожденных.
Сахарный диабет 2 типа. Эпидемиология. Основная часть пациентов с диабетом (более 90%) приходится на больных сахарным диабетом 2 типа. Диагноз СД2 ставится на основе наличия присущих этому заболеванию симптомов, однако основным критерием является концентрация глюкозы в крови >7.0 ммоль/л или >11,1 ммоль/л через 2 часа после стандартной нагрузкой глюкозой (ВОЗ, 1999). СД тип 2 развивается вследствие нарушения секреции инсулина и периферической резистентности к инсулину. Как правило, корректируется на начальных этапах с помощью диеты, физических нагрузок и пероральных сахароснижающих препаратов, а на поздних этапах - добавлением инсулинотерапии вследствие неуклонной гибели бета клеток и формирования инсулинопении.
СД2 можно назвать «эпидемией XXI века», поскольку уже в 2000 во всем мире насчитывалось более 190 000 человек, больных СД2 (3 % населения мира). По прогнозам к 2030 году процент увеличится до 4,5. Большая часть этого роста происходит у женщин и мужчин от 45 до 64 лет, живущих в развивающихся странах. Своеобразными лидерами по числу больных СД2 являются Индия (35 млн.), Китай (21 млн.) и США (19 млн.) (ВОЗ 2006). Распространенность СД2 увеличивается с возрастом населения (Wild и др.): в развивающихся странах наибольшее число диабетиков находится в возрастной группе 45—64, тогда как в наиболее развитых странах наибольшее количество больных находится в возрасте 65 лет и старше. Это различие в значительной мере говорит о различиях в возрастной структуре населения этих стран.
Факторы риска окружающей среды. Уже в 1962 году ученые предполагали, что СД2 представляет собой «бережливый генотип», который имел селективное преимущество. Предполагали, что в первобытные времена люди, которые обладали этой «метаболической бережливостью», могли накапливать большую долю энергии в виде жира, пока еда была в изобилии, было больше шансов выжить во время голода. Сейчас же население получает непрерывную подачу пищи с высокой энергетической ценностью, в том время как уровень физической активности стал значительно ниже. Это, вероятно, объясняет рост заболеваемости СД2 по всему миру.
Основным фактором риска для СД2 является ожирение (>120 % от нормального веса), а также малоподвижный образ жизни. Резкий рост ожирения во всем мире ответственен и за значительное увеличение числа заболевших. Примерно 80 % случаев СД2 типа связаны с ожирением. В последнее десятилетие экспериментально было доказано, что физическая активность и правильная диета снижают риск СД2 на 60 % (Программа по профилактике СД Study Group, 2006). Так же доказано, что внутриматочная среда является важным предиктором СД2 (Халес и Баркер, 2001), многочисленные исследования показали, что малый вес при рождении связан с недостаточным питанием плода, возникающей из-за толерантности к глюкозе и возможном развитии СД2 в течение жизни.
Роль генетики в развитии Diabetes mellitus.
Сахарный диабет 1 типа.
Близкие родственники находятся в куда большей зоне риска развития СД1, нежели несвязанные родством индивиды из общей популяции (около 6 % по сравнению с <1 % соответственно) (Dorman & Bunker 2000). Данные из многочисленных исследований свидетельствуют о том, что генетические факторы участвуют в развитии заболевания. В настоящее время есть данные, что более 20 участков генома могут быть вовлечены в развитие генетической предрасположенности к СД1. Тем не менее, из многих исследуемых кандидатов в исследовании генетической предрасположенности к СД1, наибольшая представлялась геном в HLA участке 6ой хромосомы. Этот участок содержит несколько сотен генов, принимающих участие в иммунном ответе. Наиболее тесно связанными с заболеванием являются гены HLA II класса, а именно: HLA — DR, DQ, DP. Эти гены так же известны как IDDM1, ответственны за 40—50 % наследственного риска в равзитии СД1 (Hirschhorn и другие, 2003). Оценивая гаплотив, установилось, что гены DQA1 * 0501-DQB1 * 0201 и DQA1 * 0301-DQB1 * 0302 наиболее сильно связаны с развитием СД1 (наиболее часто у народов Кавказа). Они находятся в неравновесном сцеплении с DRB1 * 03 и DRB1 * 04, соответственно. Конкретные DRB1 * 04 аллели также меняют степень риска связанную с DQA1 * 0301-DQB1 * 0302 гаплотипа. Другие сообщения о гаплотипах с предрасположенностью к СД1, включающих DRB1 * 07-DQA1 * 0301-DQB1 * 0201 среди афроамериканцев, DRB1 * 09-DQA1 * 0301-DQB1 * 0303 среди японцев, и DRB1 * 04-DQA1 * 0401- DQB1 * 0302 среди китайцев. В свою очередь ген DRB1 * 15-DQA1 * 0602-DQB1 * 0102 обладает обратным эффектом и снижает риск СД1 в большинстве популяций. (Nejentsev и др., 1997; Ли и др., 1999).
Люди, обладающие двумя гаплотипами DRB1-DQA1-DQB1, находятся в значительно более высокой степени риска СД1, нежели обладатели одного гаплотипа группы риска, эффект от заболевания, которых куда более скромный. Относительные оценки рисков зависят и от расы. Например, жители Кавказа с двумя предрасположенными к СД1 гаплотипами имеют, примерно, 6 % риск развития СД1 после 35 лет. Тем не менее, эта цифра значительно ниже в популяциях где СД1 — редкость (например, у азитов <1 %). В дополнение к IDDM1, есть и другие гены, ответственные за развитие СД1 (Anjos and Polychronakos, 2004). Они включают в себя INS и CTLA-4.
Таблица 1.
Гены и их локализации
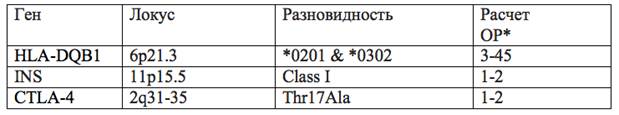
ОР* — относительный риск
INS (проинсулин). Ген INS, расположенный на 11 хромосоме локус (11p15.5), был обозначен как IDDM2. Положительные ассоциации были обнаружены с не транскрибированным переменным числом тандемных повторов (VNTR) в 5 фланкирующей области. Существует 2 распространенных разновидности. Более короткий, класс I предрасполагает к СД1 (увеличение ОР* на 1—2 пункта), в то время как более длинная разновидность — класс III выполняет преимущественно защитную функцию. Ген кодирует определенный профермент, который синтезируется β-клетками панкреатических островков. Проинсулин реструктурируется в А и Б цепи гомрона инсулина. При жкспрессии гена в тимусе способен определять иммунную толерантность к β-клеткам поджелудочной железы.
CTLA-4 (cytotoxic T lymphocyte-associated 4). Расположен на второй хромосоме (локус 2q31-35), где расположены многие гены СД1. Различные варианты этого гена связаны со многими аутоиммунными заболеваниями. CTLA-4 ингибирует функцию Т-клеток. Нарушение деятельности, связанное с разновидностью Thr17Ala может увеличить риск возникновения СД1. В целом, относительное увеличение риска для разновидности CTLA-4Ala17 было оценено в ~ 1,5.
Сахарный диабет 2 типа.
Давно известно, что СД2, от части, — наследственное заболевание. Изучение семейных анамнезов позволили выяснить, что люди, имеющие в первой степени родства больных СД2, в 3 раза сильнее подвержены риску развития СД2 в дальнейшем, в сравнении с теми, кто не имел родственников с СД2 в семейной истории болезней. Кроме того, было определено, что степень конкордантности монозиготных близнецов, которая варьировалась от 60 до 90 %, была значительно выше, нежели у дизиготных. Таким образом, очевидно, что СД2 обладает значительным генетически компонентом.
Один из подходов, используемых для определения генов, восприимчивых к болезни, является метод, основанный на идентификации генов-кандидатов. Гены-кандидаты избираются потому что они, как полагают, участвуют в функции β-клеток поджелудочной железы, метаболизма глюкозы или же участвуют в других метаболических процессах, повышающих риски возникновения СД2, например, потребление энергии, метаболизм липидов. На сегодняшний день изучено более 50 генов-кандидатов для СД2 в различных популяциях мира. Однако, результаты для практически всех генов-кандидатов были противоречивы. Возможные объяснения, касающиеся дивергентности результатов, включают в себя: небольшие размеры выборки образцов, различия в восприимчивости к СД2 различных этнических групп, изменения воздействия окружающей среды, а также взаимодействия генов и окружающей среды. В связи с рядом неточностей, данный обзор будет сфокусирован лишь на некоторых, наиболее перспективных генах-кандидатах. Они включают в себя PPARγ , ABCC8, KCNJ11, и CALPN10.
Таблица 2.
Гены и их локализации
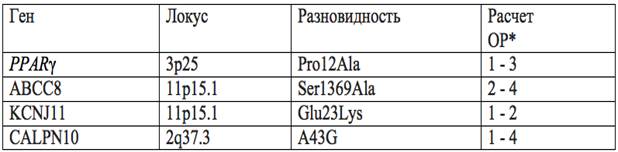
ОР* — относительный риск
PPARγ. Ген, кодирующий рецептор, активируемый пероксисомными пролифераторами, регулирующий экспрессию генов-участников процессов метаболизма. Этот ген был широко изучен, поскольку он очень важен в метаболизме липидов и углеводов, а также является мишенью для гипогликемических лекарств, известных как тиазолидиндионы. Одна из форм гена PPARγ(Pro) уменьшает чувствительность к инсулину, увеличивая риск СД2 в несколько раз. Возможно, еще более важным является тот факт, что эта разновидность очень распространена в большинстве популяций. Около 98 % европейцев несут в своем генотипе хотя бы 1 экземпляр Pro аллеля.
ABCC8. Этот ген кодирует похожий сульфонилмочевинный рецептор (SUR1), субъединица, объединенная с субъединицей Kir6.2 (кодируется геном KCNJ11U, так же известен как калиевый канал). Оба гена являются частью АТФ-чувствительного калиевого канала, который играет клюевую роль в высвобождении таких гормонов, как инсулин, глюкагон. Любая мутация в этих генах может повлиять на деятельность калиевого канала и секрецию инсулина, что в конечном итоге приводит к развитию СД2. Интересно, что эти гены располагаются очень близко друг к другу и недалеко от гена INS. Существует мнение, что гены могут работать совместно из-за непосредственной близости друг с другом.
С тех пор, как PPARγ, ABCC8, KCNJ11 стали использоваться в качестве мишеней для лекарственных средств, применяемых в лечении СД2, появились фармакологические возможности для поддержания хорошего гликемического контроля. Ответ на гипогликемические препараты может быть связан с генотипом. Таким образом, генетическое тестирование способно не только определить тех, кто находится в группе высокого риска развития СД2, но может быть также полезен в качестве ориентиров схемы лечения для СД2.
СAPN10(кальпаин-10). Кодирует внутриклеточный кальций-зависимый цистеиновых протеаз, которые повсеместно экспрессируются (Cox и другие, 2004). Мутации в кальпаине способны повлиять на активность секреции инсулина и, следовательно, на склонность к СД2. Вклад этого локуса в повышение риска СД2 наиболее значителен в Американо-Мексиканской популяции.
Сахарный диабет взрослого типа у молодых.
Более известен как MODY. MODY — необычная форма СД2 (менее 5 % всех случаев СД2). В целом, любой случай СД2 до 25 лет — MODY. Заболевание характеризуется медленным развитием симптомов, отсутствием кетоза и отсутствием доказательств аутоиммунного заболевания β-клеток панкреатических островков. Заболевание чаще всего контролируется без экзогенного введения инсулина. ΜΟDY отображается аутосомно-доминантным типом наследования и, как правило, охватывает три поколения. Благодаря достижениям современной генетики, в настоящее время известно, что существует, как минимум, 6 форм ΜΟDY, каждая из которых вызывается мутацией в гене, непосредственно связанным с функцией β-клеток. В настоящее время открыто лишь 85 % генов несущих в себе мутации, вызывающие заболевание, однако можно ожидать, что в ближайшее время будут открыты и остальные.
Роль генетики в лечении и профилактике сахарного диабета.
В настоящее время нет способов по предотвращению СД1. Пожизненные инъекции инсулина доступны лишь для лечения заболевания. Таким образом, можно с уверенностью сказать, что в настоящее время генетика бессильна в управлении или профилактике СД1. Хотя лекарство от СД1 в настоящее время недоступно, были разработаны несколько крупных многонациональных исследований для оценки первичных и вторичных мероприятий. Тестируемые мероприятия включали профилактический инсулин в виде назального спрея (проект DIPP в Финляндии), оральный инсулиновый спрей и инъекционный инсулин (Профилактические исследования DPT-1 в США), а также введение больших доз никотинамида (European Nicotinamide Diabetes Intervention Trial — ENDIT). Все исследования проводились на потенциальных диабетиках в семьях с, по крайней мере, 1 ребёнком с СД1. На сегодняшний день ни один из исследуемых мероприятий не позволили снизить риск или отсрочить развитие СД1.
Сахарный диабет 2 типа.
В отличие СД1, СД2, как правило, может быть предотвращен путем поддержания веса тела с учетом возраста и физической активности. Хотя сообщения общественного здравоохранения, которые подчеркивают питательную диету и регулярную физическую активность стали обычным явлением, они не были эффективными в плане профилактики заболевания. Учитывая недавние эпидемии ожирения, очевидно, что в настоящее время стратегии вмешательства, игнорируются большинством лиц в общей популяции. Лидеры проекта «Генома человека» предсказывали, что генетические тесты станут доступны для многих распространённых заболеваний в течение первого десятилетия 21-го века. Это позволит людям узнать их индивидуальные уязвимые места и восприимчивости, чтобы уменьшить риски, применяя вмешательства, основанные на медицинском наблюдении, изменении образа жизни, диеты или лекарственной терапии.
Список литературы:
1. Alberti K.G. M.M., Zimmett P. Definition, diagnosis and classification of diabetes mellitus and its complications part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet Med, 1998. 15: 539—553.
2. Anjos S., Polychronakos C. Mechanisms of genetic susceptibility to type 1 diabetes: beyond HLA. Mol Genet Metab, 2004. 81: 187—195.
3. Barroso I., Luan J., Middelberg R.P.S., et al. Candidate gene association study in type 2 diabetes indicates a role for genes involved in B-Cell function as well as insulin action. PLoS Biol, 2003. 1: 41—55.
4. Bennett S.T., Wilson A.J., Esposito L. Insulin VNTR allele-specific effect in type 1 diabetes depends on identity of untransmitted paternal allele. Nat Genet, 1997. 17: 350—352.
5. Bloomgarden Z.T. Type 2 diabetes in the young: the evolving epidemic. Diabetes Care, 2004. 27: 998—1010.
6. Borch-Johnsen K., Joner G., Mandrup-Poulsen T., et al. Relation between breast-feeding and incidence rates of insulin-dependent diabetes mellitus. A hypothesis. Lancet, 1984. 2: 1083—1086.
7. Cockburn B.N., Bermano G., Boodram L.-L.G., et al. Insulin promoter factor-1 mutation and diabetes in Trinidad: identification of a novel diabetes-associated mutation (E224K) in an Indo-Trinidadian family. J Clin Endocrinol Metab, 2004. 89: 971—978.
8. Collins F.S., McKusick V.A. Implications of the Human Genome Project for medical science. JAMA, 2001. 285: 540—544.
9. Cox N.J., Hayes M.G., Roe C.A., et al. Linkage of calpain 10 to type 2 diabetes: the biological rationale. Diabetes, 2004. 53: S. 19—25.





