БИОЛОГИЧЕСКИЕ АСПЕКТЫ СТАРЕНИЯ ЧЕЛОВЕКА. ТЕЛОМЕРНАЯ ТЕОРИЯ
Секция: 4. Медицинские науки

XXIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
БИОЛОГИЧЕСКИЕ АСПЕКТЫ СТАРЕНИЯ ЧЕЛОВЕКА. ТЕЛОМЕРНАЯ ТЕОРИЯ
Старение человека по своей природе представляет собой биологический процесс планомерного угнетения жизнеспособности частей и систем тела человека.
Проблемы сдерживания процессов старения и продления жизни являлись актуальными во все периоды человеческой истории, но особенно остро они заявляют о себе сейчас, в XXI веке. Верные решения в этом направлении могли бы снять остроту многих крайне актуальных проблем.
1. Демографическая — главная. Во всех высокоразвитых странах отмечается старение населения при снижении рождаемости. К началу XXI века в развитых странах доля населения, достигшего возраста 65 лет и более составляет 10—14 %, через 20 лет этот показатель может удвоиться.
2. Социальные: продление жизни в состоянии активной старости на значительный промежуток времени В обществах с высоким уровнем индустриализации и урбанизации статус пожилых людей заметно изменился, уменьшив значение пожилых людей, а в некоторых случаях даже достигнув негативного отношения к старым людям — эйджизма.
3. Психологические — психологическое сдерживание старения.
4. Медицинские. Существует прямая связь основных болезней человека с возрастными нарушениями. Человек в позднем возрасте характеризуется большей уязвимостью к болезням, многие из которых связаны со снижением эффективности иммунной системы в пожилом возрасте.
· Экономические. В связи со снижением способности выполнять большинство типов работ в индустриальных и постиндустриальных обществах пожилые люди постепенно теряют источники дохода.
· Политические. Они сводятся к своевременному решению важнейших задач поддержания эффективности многих систем государства, связанных с обеспечением пожилых людей.
· Юридические. Пожилые люди часто лишаются некоторых прав. Так, например, во многих странах установлено возрастное ограничение на право вождения автомобиля (в среднем до 75 лет), а также известным фактом является негласное правило на нежелательное занятие отдельных должностей, в частности — руководящих.
Таким образом, главной задачей, стоящей перед обществом, наукой и перед самими пожилыми людьми, является как предотвращение старения (что, однако пока звучит весьма утопично), так и умелое внедрение в повседневную жизнь такого понятия, как «правильное старение». Данное определение включает сокращение вероятности болезней, разнообразные и доступные возможности к обучению и трудовой деятельности, а также активную социализацию, в особенности среди людей пожилого возраста.
Итак, известны две основные точки зрения на причины старения:
1. Старение — генетически запрограммированный процесс, результат закономерного развития программы, заложенной в генетическом аппарате. Эта программа имеет первичное значение для старения, и в ходе ее реализации организм целенаправленно делает себя уязвимым для различных повреждающих факторов внешней и внутренней среды, которые сами по себе, без действия этой программы, мало могут повлиять на темп старения.
2. Старение — это стохастический (вероятностный), случайный процесс, обусловленный «изнашиванием» организма (подобно тому, как изнашивается все в природе) в результате самоотравления продуктами жизнедеятельности и повреждения, наносимого постоянно действующими вредными факторами внешней среды. Специальной генетической программы старения не существует, но, так как свойства организма генетически детерминированы, то неправильная реализация генетических программ вследствие повреждения и накопления ошибок в генетическом аппарате и/или вследствие несовершенства этих программ приводит к возникновению феномена старения.
Первые считают, что старение является не необходимым свойством живых организмов, а запрограммированным процессом. Согласно им, старение развилось в результате эволюции из-за некоторых преимуществ, которые оно даёт целой популяции.
Теории повреждения предполагают, что старение является результатом природного процесса накопления повреждений со временем, с которыми организм старается бороться, а различия старения у разных организмов является результатом разной эффективности этой борьбы. Сейчас последний подход считается установленным в биологии старения.
Клеточный ответ на старение.
Рудольф Вирхов в 1856 году опубликовал труд «Целлюлярная патология, основанная на физиологическом и патологическом учении о тканях», в котором отметил, что именно с клетки начинаются практически все физиологические и патологические процессы и изменения.
Важным вопросом старения на уровне клеток и ткани является клеточный ответ на повреждения. Из-за стохастической природы повреждений отдельные клетки стареют, например, в связи с достижением границы Хейфлика, быстрее остальных клеток. Такие клетки потенциально могут угрожать здоровью всей ткани. В наибольшей мере такая угроза проявляется среди стволовых клеток, у которых происходит быстрое деление, таких как клетки костного мозга или эпителия кишечника, в связи с большим потенциалом таких тканей в создании мутантных, возможно раковых, клеток. Известно, что именно клетки этих тканей быстро отвечают на повреждения инициацией программы апоптоза. Например, даже низкие дозы радиации (0,1 Gy) вызывают апоптоз в клетках эпителия кишечника, а даже слабый химический стресс вызывает апоптоз стволовых клеток старых мышей.
Как правило, в таких тканях массовый апоптоз является признаком возрастания числа повреждений клеток. С другой стороны, в других тканях ответом на возрастание уровня повреждений может быть арест клеток на определённой стадии клеточного цикла для прекращения деления. Баланс между апоптозом и арестом повреждённых клеток наиболее важен как компромисс между старением и раком. То есть, или организм должен убить повреждённые клетки, или дать им возможность существовать, увеличивая риск возникновения рака. Таким образом, p53 и сокращение теломер, важные факторы в вызывании апоптоза клеток, могут рассматриваться как пример антагонистической плейотропии, как было указано выше.
Подводя итог, по современным представлениям, клетка стареет в результате накопления повреждений. Скорость этого накопления определяется, в первую очередь, генетически определёнными затратами на ремонт и поддержку клеточных структур, которые в свою очередь определяются организмом для удовлетворения своих экологических потребностей. Долгоживущие организмы имеют большие затраты (иногда более длительный метаболизм), что приводит к более медленному накоплению повреждений. Для борьбы с риском, который представляют собой повреждённые клетки, организм создал систему механизмов для борьбы с ними, которые часто включают второй ряд компромиссов.
1. Теломеразная теория старения клеток.
Наиболее яркой на сегодняшний день является теломерная теория строения, или теория маргинотомии. В биологии до определенного времени считалось, что каждая клетка потенциально способна к пролиферации в идеально благоприятных условиях бесконечное число раз. Однако от этого мнения пришлось отказаться в конце 20 века (1961 г.) Именно тогда ученые Л. Хейфлик и П. Мурхед установили, что нормальные фибробласты (клетки соединительной ткани) человека, взятые у эмбриона и помещенные в питательную среду, делятся ограниченное число раз, приблизительно 50. Эксперимент был многократно воспроизведен в других лабораториях мира, однако выяснить причину такого необычного поведения клеток тогда не получалось. Было лишь введено обозначение для неожиданного открытия — «лимит Хейфлика».
На этом исследования особенностей клеточного старения, разумеется, не закончились. Всего лишь через десятилетие (1971 г.) русский ученый А.М. Оловников, изучая исследования и эксперименты своих предшественников, а также, опираясь на собственные умозаключения и наблюдения, пришел к невероятно важному выводу, что при каждой репликации хромосом, а, то есть и с каждым их делением, концевые участки этих самых хромосом, именуемые теломерами, укорачиваются. Более того, при достижении, как думалось, генетически определенного предела укорачивания репликация хромосом в соматических клетках прекращается, следовательно, клетки прекращают деление. В результате происходить биологический процесс старения клетки, приводящий к неминуемой гибели клетки.
Позже (1985 г.) ученые Грейдер и Блэкборн обнаружили и описали теломеразу — клеточный фермент, имеющий чрезвычайно удивительное влияние на клетку. Они раскрыли механизм действия теломеразы — это повторяющееся кодирование с помощью РНК-матрицы, входящей в состав теломеразы, новых нуклеотидных последовательностей теломеры и, таким образом, восстановление ее исходной длины.
Теломера.
Теломера — это участок хромосомы, локализованный на ее конце. Линейные хромосомы имеют по две теломеры. Теломера содержит специальные последовательности ДНК (нуклеотидные последовательности), обеспечивающие точную репликацию хромосом. Для теломерных участков хромосом характерна значительная гетерогенность в разных клетках и тканях даже одного организма.
При каждом делении клетки длина теломеры укорачивается на определенное число нуклеотидных последовательностей. При достижении некоего предела укорочения теломеры репликация хромосом прекращается, и клетка перестает делиться.
Теломераза.
Теломераза — фермент (белок), основная функция которого достраивать новые нуклеотидные последовательности в теломерных участках хромосом. Теломераза несет собственную РНК-матрицу, и поэтому относится к классу обратных транскриптаз.
В соматических клетках ген теломеразы на протяжении всей жизни клеток остается не активным. Он активен только в половых клетках, в стволовых клетках, а также в соматических клетках, подвергнувшихся малегнизации. Именно поэтому эти клетки носят название «иммортализированные», то есть — бессмертные.
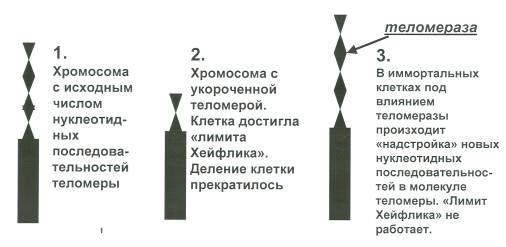
Рисунок 1. Теломерная теория (теория маргинации) А.М. Оловникова
В соматических клетках человека число нуклеотидных последовательностей (н. п.) в теломере достигает 10—15 тысяч. При укорочении теломеры на 2—3 тыс. н. п. репликация ДНК прекращается, и клетка перестает делиться. То есть, клетка достигает «лимита Хейфлика».
Клеточный механизм реализации феномена старения и гибели клетки.
Эксперименты с переживающими клетками в культуре ткани показали, что теломеры нормальной длины вызывают сайленсинг (от английского — silence «молчание»), то есть репрессию ряда прилежащих генов. При укорочении теломер эти гены активируются. В числе этих генов есть ген р53, ответственный за синтез одноименного белка — р53, основная функция которого блокирование митоза клеток на уровне «чек-пойнтов» митоза G1 и G2 (инактивация циклинов), а также индукция процесса апоптоза клетки. Данные свойства белка р53 позволяют его считать ответственным и за супрессию процесса малегнизации клетки, так как при нерепарированном изменении генома клетки им предупреждается как появление клона мутировавших клеток, так и инициируется апоптоз, то есть клетка с измененным геномом самоуничтожается. Схематически эти процессы можно представить с помощью Рис. 2. На нем представлен генетический механизм старения и гибели клетки: А — этап блокирования митоза, Б — этап индукции апоптоза.
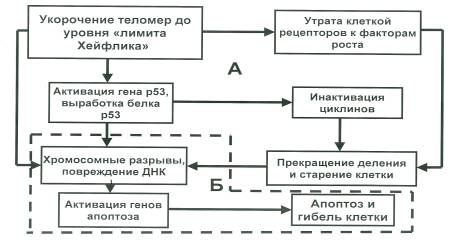
Рисунок 2. Генетический механизм старения и гибели клетки (А — этап блокирования митоза; Б — этап индукции апоптоза клетки)
В связи с вышеизложенной информацией было бы интересно затронуть еще один аспект, касающийся данной темы. Он весьма важен с медицинской точки зрения, в особенности из-за современной актуальности борьбы с различными онкологическими заболеваниями. Поэтому хотелось бы рассказать о таком явлении, как иммортализация опухолевых клеток.
Иммортализация опухолевых клеток.
Патологи и клиницисты, изучавшие механизмы канцерогенеза, давно уже убедились в том, что клетки злокачественной опухоли, полученные путем биопсии из организма экспериментальных животных или человека, способны жить и развиваться (то есть делиться) в культуре ткани практически вечно. Известен пример, когда в 1951 в США в госпитале Университета Джона Гопкинса при биопсии рака шейки матки у женщины по имени Генриетта Лаке были взяты опухолевые клетки. Они были распространены во многие страны мира и, что удивительно, в лабораториях в культуре ткани до сих пор поддерживается их жизнеспособность. К сожалению, Генриетта Лаке умерла от данного онкологического заболевания, но клетки ее опухоли под индексом HeLa продолжают служить людям, так как на этом материале изучаются механизмы канцерогенеза, апробируются различные противораковые препараты.
Изучив данный случай, непременно возникает вопрос о том, как именно осуществляется механизм бессмертия, или иммортализации данных опухолевых клеток? Почему они сумели обойти известное нам правило «лимита Хейфлика»? Какая особенность позволяет им преодолеть столь внушительный для нас барьер бессмертия и вечной жизни?
Для ответов на эти вопросы был проведен ряд экспериментов, в ходе которых выяснилось, что в опухолевых клетках не происходит укорочение теломер. Помимо этого, им посчастливилось всегда иметь в наличии теломеразу, которую в настоящее время зачастую используют в качестве маркера опухолевого процесса. Однако мы знаем, что решающую роль в жизнедеятельности клетки играет экспрессия строго определенных генов, то есть клеточное бессмертие должно быть связано с какими-либо изменениями в генетическом аппарате клетки. Многочисленные эксперименты показали, что в клетках в процессе их малегнизации происходит активация гена теломеразы, которые в нормальных клетках, как уже указывалось выше, находятся в неактивном состоянии. Иначе говоря, в клетке, воспринявшей сигнал малегнизации, происходит с одной стороны блокирование генов-репрессоров опухолевого процесса (например, гена р53), а с другой, активация гена, ответственного за выработку теломеразы.
Схема механизмов иммортализации опухолевых клеток изображена Рис. 3.
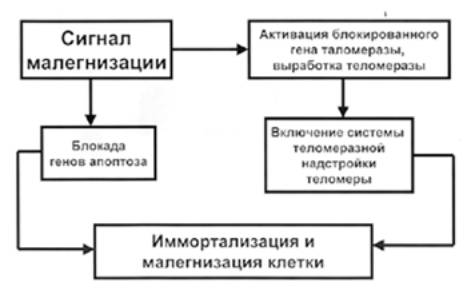
Рисунок 3. Механизмы иммортализации опухолевых клеток
Экспериментальные факты, подтверждающие теломеразную теорию старения клеток или ставящие ее под сомнение.
В настоящее время теломеразная теория старения клеток считается экспериментально доказанной. Приведем некоторые доводы в пользу этого утверждения.
1. Фибробласты эмбриона человека, прошедшие в культуре ткани определенное число делений (например, 30) и замороженные на длительное время, после размораживание делятся не более 20 раз и, достигнув лимита Хейфлика, прекращают деление и погибают.
2. Соматические клетки, взятые у животных одного вида, но разного возраста, достигают лимита Хейфлика в разное время. Чем старше животное, тем меньшее количество делений совершают клетки.
3. Теломеры соматических клеток больных синдромами наследственной прогерии (синдром Хатчинсона-Гилфорда и синдром Вернера) при каждом делении укорачиваются на большее число н. п., чем клетки здорового организма.
4. Ген теломеразы, введенный в культуру соматических клеток, увеличивает лимит Хейфлика на 20—30 делений.
5. Теломеры половых клеток при их делении не укорачиваются, но даже могут удлиняться. В половых клетках ген теломеразы активен и в них идет постоянное образование теломеразы.
6. Ген теломеразы активен и в опухолевых клетках. Теломераза является маркером опухолевого процесса.
7. Введение в культуру опухолевых клеток веществ, блокирующих или разрушающих теломеразу, приводит к остановке безудержного размножения этих клеток.
С другой стороны, есть экспериментальные данные, которые в определенной степени противоречат теломеразной теории старения клеток, а именно:
1. В организме человека и животных имеются неделящиеся клетки, срок жизни которых сравним со сроком жизни макроорганизма (например, нейроны головного мозга). Их гибель не обусловлена достижением «лимита Хейфлика».
2. Заражение клеток вирусом SV40 приводит к тому, что они способны совершать по 20—40 делений сверх «лимита Хейфлика». Однако, в этих клетках отсутствует теломераза и в них продолжается укорочение теломер.
3. В некоторых случаях введение в клетку активного гена теломеразы (например, в клетки молочной железы) приводит к удлинению теломер, но не сопровождается увеличением лимита Хейфлика.
4. Помимо укорочения теломер в соматических клетках наблюдается и много других изменений ДНК. Например, увеличение числа разрывов в цепях ДНК, усиление прочности связывания белков с ДНК, снижение активности ферментов репарации ДНК и др. В результате этих процессов, несмотря на то, что теломеры еще не достигли критического укорочения, в клетке включаются механизмы блокады митотического цикла, она перестает делиться и погибает.
Подводя итог изложенному, возникает необходимость поставить несколько вопросов, ответы на которые позволят создать более полное представление, как о проблеме старения клеток, так и о старении организма в целом. Оставив данные вопросы без внимания, мы рискуем подставить под сомнение и все изложенное выше.
1. Первый вопрос можно сформулировать следующим образом: следует ли считать теломеразный механизм единственным фактором, вызывающим старение соматических клеток? Если под термином «старение клеток» понимать только остановку митоза, то это, очевидно, не так. Вспомним, хотя бы, о том, что блокада митоза клеток может включаться и в клетках, длина теломер которых еще не достигла критического уровня. Так происходит в клетках, получивших в силу тех или иных причин нерепарированное повреждение ДНК. Как известно, в этих случаях активация гена р53 и других родственных ему по функции генов приводит к блокаде митоза и инициации процесса апоптоза. Эти же явления имеют место и в случае малегнизации клетки. Таким образом, становится ясно, что для организма наиболее важно избавится от поврежденных клеток, способных в случае их выживания дать клон клеток с нарушенными свойствами и функциями, что может грозить непредсказуемыми последствиями (например, образованием злокачественной опухоли). Следовательно, уничтожение путем апоптоза клеток, достигших лимита Хейфлика, это только частный случай сохранения морфологического и функционального гомеостаза организма, так как в длительно живущих и многократно делящихся клетках возможно накопление метаболических ошибок и повреждение генома.
2. Второй вопрос: можно ли напрямую связать теломеразный механизм старения клеток со старением организма в целом? А также можно ли считать теломерный механизм единственным в своем роде фактором, регулирующим биологическое старение? На этот вопрос очевидно нельзя ответить положительно. Подтверждение этому легко обнаружить, элементарно исследуя числовые показатели лимита Хейфлика и сравнивая их со средней продолжительностью жизни. У 90-летних доноров брались фибробласты, которые в культуре делились всего на 20 раз меньше, чем эмбриональные фибробласты. Как известно, лимит Хейфлика равен 50. Таким образом, у людей, практически достигших (по современным представлениям) возраста, по продолжительности весьма близкого к предельному сроку жизни представителей человечества, лимит Хейфлика далеко не исчерпан. Более того, высказывание самого Л. Хейфлика наталкивает нас на мысль о том, что в вопросе старения организма необходимо учитывать различные факторы: «…я не верю в то, что старение и смерть людей наступает вследствие прекращения деления их клеток».
Судя по всему, генетический контроль продолжительности жизни клетки, основанный на контроле за числом ее митозов — это только один из механизмов, позволяющих исключить из соответствующей клеточной популяции долгоживущие клетки, которые за время своего существования (у человека — это многие десятилетия) возможно, сумели в результате суммации молекулярных и метаболических ошибок приобрести признаки вредные для существования организма. Современная геронтологическая наука говорит о том, что старение организма и смерть его от старости — это результат очень многих системных изменений, объяснить которые невозможно только с точки зрения теломеразной теории старения клеток. К сожалению, теломераза — это только очередная «панацея» в долгой истории поисков человечеством средств продления жизни.
Таким образом, можно подвести итог и сказать, что на сегодняшний день пока еще недостаточно знаний, чтобы беспрекословно и окончательно сделать вывод о причине и механизмах биологического старения. Необходимо принимать во внимание многочисленные концепции в данной области, которые были сформулированы в различное время и различными ученым. Так среди них можно назвать свободнорадикальную концепцию, теорию соматических мутаций, теорию накопления измененных белков, митохондриальную теорию. Про них не было сказано выше, но они также оказали значительное влияние на исследование вопросов биологического старения. Возможно, эти концепции, обычно рассматривающиеся как альтернативные, окажутся взаимодополняющими. В любом случае, по мнению большинства ученых, интенсивность и масштабность исследований феномена старения во многих лабораториях мира, а также громадный накопленный материал по этой проблеме позволяют прогнозировать появление в скором будущем значительного качественного результата, который выразится в появлении способов радикального продления жизни. Поэтому уже сейчас некоторые называют XXI в. «веком бессмертия».
Список литературы:
1. Атлас по генетике под редакцией академика РАО проф., д.м.н. Н.В. Чебышева. Москва. 2008 год.
2. Биология. Углубленный курс. Учебник для бакалавров. Под редакцией академика РАМН, профессора В.Н. Ярыгина. Юрайт, 2013 г.
3. Биология. Учебное издание. Чебышев Н.В., Кузнецов С.В., Зайчикова С.Г., Гуленков С.И., Козарь М.В. Том 1. 2010 год.
4. Биология (биологические процессы и законы). К. Вилле, В. Детье. Мир, 1975 год.
5. http://www.moscowuniversityclub.ru/home.asp?artId=14529.
6. https://ru.m.wikipedia.org/wiki/Клеточное_старение.





