ФЕНОТИПИЧЕСКАЯ И ГЕНОТИПИЧЕСКАЯ УСТОЙЧИВОСТЬ ШТАММОВ STAPHYLOCOCCUS AUREUS К АМИНОГЛИКОЗИДАМ
Секция: 2. Биологические науки

XXXVI Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ФЕНОТИПИЧЕСКАЯ И ГЕНОТИПИЧЕСКАЯ УСТОЙЧИВОСТЬ ШТАММОВ STAPHYLOCOCCUS AUREUS К АМИНОГЛИКОЗИДАМ
ВВЕДЕНИЕ
Staphylococcus aureus является одним из основных патогенов человека и животных, вызывающим широкий спектр заболеваний, а также различные осложнения, такие как инфекции области хирургического вмешательства (ИОХВ) и остеомиелит [2, 6, 8].
Одним из общепринятых способов лечения таких осложнений является локальная антимикробная терапия антибиотиками группы аминогликозидов, которые вводят в состав костного цемента, применяемого для фиксации эндопротеза и заполнения костных дефектов, образовавшихся в результате остеомиелита [5, 9,13].
Устойчивость S. aureus к аминогликозидам обусловлена наличием генов, кодирующих аминогликозид-модифицирующие ферменты. Данные ферменты нарушают связывание молекул антибиотика с рибосомами бактериального возбудителя, что препятствует антибактериальному действию аминогликозидов. Несмотря на значительное число генов устойчивости к аминогликозидам, описанных для S. aureus, большая часть данных о распространенности этих генов относится к штаммам, выделенным в других странах [11, 12, 14, 16]. Кроме того, существует нехватка данных о корреляции фенотпической (бактериологичесий анализ) и генотипической (генетический анализ) устойчивости штаммов S. aureus к аминогликозидам.
Целью настоящего исследования является сравнительный анализ штаммов S. aureus по их фенотипической и генотипической устойчивости к гентамицину, тобрамицину и амикацину.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили 119 штаммов S. aureus из них 29 MRSA и 90 MSSA, выделенных от пациентов от пациентов, проходивших лечение в РНИИТО им. Р.Р. Вредена с диагнозом ИОХВ после травм и ортопедических операций или остеомиелита.
Исследуемые штаммы выращивали на колумбийском агаре с 5% бараньей кровью (Биомедиа, РФ) и агаре Мюллера-Хинтона (Oxoid, Великобритания) в течение 18-20 часов при 37оС. Фенотипическую чувствительность штаммов к гентамицину (10 мкг), амикацину (30 мкг) и тобрамицину (10 мкг) определяли при помощи диско-диффузионного метода (ДДМ) в соответствии с МУК 4.2.1890-04 и международными стандартами EUCAST [3, 10] и применением дисков для определения чувствительности производства Oxoid (Великобритания). S. aureus ATCC 29213 был использован в качестве контрольного штамма.
Для генетического анализа бактериальных геномов и подбора праймеров использовали программы BLAST, PrimerBlast и PerlPrimerv1.1.21.
ДНК исследуемых штаммов выделяли при помощи коммерческого набора для выделения ДНК из бактериальных клеток (S-сорб, РФ). ПЦР-анализ проводили на амплификаторе cfx96 (Bio-Rad, США) с использованием праймеров, описанных ранее [4].
Условия реакции: 3 мин при 95,0оС; 33 цикла: 10 сек при 95,0оС; 15 сек при температуре отжига праймеров; 15 сек при 72оС. ПЦР-продукты визуализировали при помощи электрофореза в 1% агарозном геле и окраски бромистым этидием.
Статистический анализ сопряженности между наличием каждого из генов aac(6’)-Ie/aph(2”), ant1, aac, ant(4')-Ia и чувствительностью/устойчивостью штаммов к гентамицину, тобрамицину и амикацину проводили с помощью коэффициентасопряженности Пирсона, в программе Exсel, Mathcad [7].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фенотипическая чувствительность штаммов к гентамицину, тобрамицину и амикацину (ДДМ)
119 штаммов штамма S. aureus были исследованы на чувствительность к гентамицину (Gen), амикацину (Ami) и тобрамицину (Tob). 79,31% штаммов MRSA и 2,2% штаммов MSSA были резистентны к гентамицину и тобрамицину. 55,17% штаммов MRSA были резистенты к амикацину. Резистентных к амикацину штаммов MSSA выявлено не было (табл. 1). 21% всех штаммов был резистентен ко всем трем антибиотикам.
Таблица 1.
Распределение изученных штаммов S. aureus по их фенотипической устойчивости к аминогликозидам
|
Число штаммов |
Фенотип |
||||
|
Gen+, Ami+, Tob+ |
Gen-, Ami-, Tob- |
Gen+, Ami-, Tob+ |
|||
|
MRSA |
29 |
55,17% |
24,14% |
24,14% |
|
|
MSSA |
90 |
0 |
96,7% |
0 |
|
|
Всего |
119 |
13,4% |
78,9% |
5,9% |
|
|
Число штаммов |
Фенотип |
||||
|
Gen+ |
Ami+ |
Tob+ |
|||
|
MRSA |
29 |
79,31% |
55,17% |
79,31% |
|
|
MSSA |
90 |
2,22% |
0 |
2,22% |
|
|
Всего |
119 |
21% |
13,4% |
21% |
|
“Gen+”, “Ami+”, “Tob+” - устойчивость к гентамицину, амикацину и тобрамицину соответственно
“Gen-“, “Ami-“, “Tob-“ – чувствительность к гентамицину, амикацину и тобрамицину соответственно.
Сходная распространенность гентамицин-резистентных штаммов MRSA описана для ряда других стран: 60,53% (Греция), 61,7% (Япония) и 90,2% (Турция) [12, 14, 16]. Также в Японии была показана большая устойчивость штаммов MRSA к тобрамицину (95,3%), чем к гентамицину (61,7%). В то время как в нашем исследовании % устойчивых к гентамицину и тобрамицину штаммов MRSA был одинаковым (79,31%) (табл.1).
Генотипическая устойчивость изученных штаммов к гентамицину, тобрамицину и амикацину (ПЦР)
В ходе работы 119 штаммов S. aureus были изучены на наличие в их геноме генов устойчивости к аминогликозидам. Полученные результаты приведены в таблице 2.
Таблица 2.
Результаты ПЦР-анализа штаммов S. aureus на наличие генов устойчивости к аминогликозидам
|
Ген |
S. aureus (n=119) |
MRSA (n=29) |
MSSA (n=90) |
|||
|
n |
% |
n |
% |
n |
% |
|
|
aac(6')-Iе/aph(2'') |
24 |
20,2 |
22 |
18,5 |
2 |
1,7 |
|
ant1 |
20 |
16,8 |
13 |
5,9 |
7 |
10,9 |
|
aac |
11 |
9,2 |
10 |
8,4 |
1 |
0,8 |
|
ant(4')-Ia |
0 |
0 |
0 |
0 |
0 |
0 |
“n” – число штаммов; “%” – % штаммов
Среди изученных штаммов наиболее распространенным был ген aac(6’)-Ie/aph(2”), выявленный у 20,2% всех изученных штаммов (MRSA+MSSA). Гены ant1 и aac присутствовали в геномах 16,8% и 9,2% штаммов, соответственно. Ген ant(4’)-Ia среди изученных штаммов выявлен не был, хотя в ряде исследований он встречается у 26–84% штаммов в зависимости от их региона выделения [11, 12, 15].
Сопоставление результатов ДДМ и ПЦР
В результате проведенного исследования было показано, что в геноме всех изученных штаммов, резистентных к гентамицину и тобрамицину присутствовал ген aac(6’)-Ie/aph(2”) (рис. 1). В тоже время данный ген не был выявлен ни у одного из штаммов, чувствительных к данным антибиотикам.
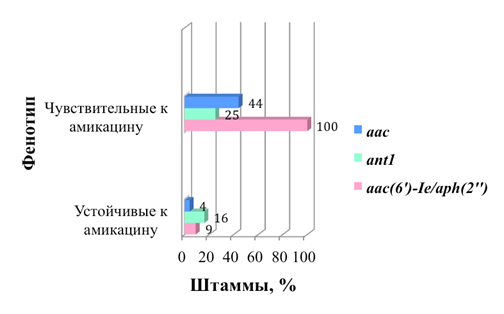
Рисунок 1. Присутствие в геноме штаммов генов aac(6’)-Ie/aph(2”), ant1 и aac в зависимости от устойчивости/чувствительности штаммов к гентамицину и тобрамицину
Статистический анализ полученных данных при помощи коэффициента пирсона показал высокую степень сопряженности между наличием данного гена в геноме штаммов и их устойчивостью к гентамицину и тобрамицину (коэф.=1).
ЗАКЛЮЧЕНИЕ
Принимая во внимание полученную высокую сопряженность между наличие гена aac(6’)-Ie/aph(2”) у штаммов S. aureus, устойчивых к гентамицину и тобрамицину, а также высокую распространенность данного гена согласно публикациям других авторов [11, 12], данный ген может быть рекомендован качестве генетического маркера устойчивости штаммов S. aureus к гентамицину и тобрамицину.
Список литературы:
1. Божкова С.А. Профиль резистентности возбудителей как основа выбора эффективного антибиотика при стафилококковых инфекциях протезированных суставов // Клин. микробиол. антимикроб. химиотер. – 2013. Т. 15, №2. – С. 115–123.
2. Божкова С.А., Разоренов В.Л., Петрова Т.М. Микробиологический мониторинг – основа рациональной стратегии и тактики антибактериальной терапии инфекции костей и протезированных суставов // Тольяттинский медицинский консилиум. – 2011. – Т. 3–4. – С. 33–42.
3. МУК 4.2.1890-04. Методические указания определения чувствительности микроорганизмов к антибактериальным препаратам. – введ. 04.03.2004 – Спб.: Клин. микробиол. антимикроб. химиотер. – 2004. – С. 324–325.
4. Полякова Е.М., Божкова С.А. Сравнительная характеристика фенотипической и генотипической устойчивости к аминогликозидам штаммов Staphylococcus aureus, выделенных в травматолого-ортопедическом стационаре // Клиническая лабораторная диагностика. – 2015. – Т. 60, № 11. – С. 50–53.
5. Привольнев В.В., Родин А.В., Каракулина Е.В. Местное применение антибиотиков в лечении инфекций костной ткани // Клин. микробиол. антимикроб. химиотер. – 2012. – Т.14, №2. – С. 118–131.
6. Розова Л.В., Годовых Н.В. Сравнительная характеристика видового состава микроорганизмов при хроническом посттравматическом и гематогенном остеомиелите // Гений Ортопедии. – 2014. – Т. 2. – С. 56–59.
7. Фёрстер Э., Рёнц Б. Методы корреляционного и регрессионного анализа. Руководство для экономистов // Финансы и статистика. – 1983. – С. 270–275.
8. Шаповал С.Д. Резистентные и полирезистентные возбудители гнойно-некротических осложнений синдрома диабетической стопы // Новости хирургии. – 2015. – Т. 23, №1. – С. 70–76.
9. Duffy R.K., Shafritz A.B. Bone cement // J Hand Surg Am. – 2011. – Vol. 36,
№ 6. – P. 1086–1088.
10. EUCAST Clinical Breakpoint Table v. 5.0 (2015). Available at: http://www.eucast.org/ bles.
11. Hauschild T. Aminoglycosides resistance in clinical isolates of Staphylococcus aureus from a University Hospital in Bialystok // Folia Histochem Cytobiol. – 2008. – Vol. 46, №2. – P. 225–228.
12. Ida T. Identification of Aminoglycoside-Modifying Enzymes by Susceptibility Testing: Epidemiology of Methicillin-Resistant Staphylococcus aureus in Japan // J Clin Microbiol. – 2001. – Vol. 39, №9. – P. 3115–3121.
13. Jiranek W.A., Hanssen A.D., Greenwald A.S. Antibiotic-loaded bone cement for infection prophylaxis in total joint replacement // J Bone Joint Surg Am. – 2006. – Vol. 88, № 11. – P. 2487–2500.
14. Polyzou A. Predominance of methicillin-resistant staphylococcus aureus clone susceptible to erythromycin and several other non-β-lactam antibiotics in a Greek hospital // J Antimicrob Chemother. – 2001. – Vol. 48, № 2. – P. 231–234.
15. Schmitz F.J. The prevalence of aminoglycoside resistance and corresponding resistance genes in clinical isolates of staphylococci from 19 European hospitals // J Antimicrob Chemother. – 1999. – Vol. 43, № 2. – P. 253–259.
16. Yıldız Ö. Antimicrobial susceptibility and resistance mechanisms of methicillin resistant Staphylococcus aureus isolated from 12 Hospitals in Turkey // Ann Clin Microbiol Antimicrob. – 2014. – Vol. 13, № 1. – P. 44.





