ОКСИДНЫЕ ПЛЕНКИ: ВИДЫ, МЕХАНИЗМ ОБРАЗОВАНИЯ, ЗАЩИТНЫЕ СВОЙСТВА
Секция: Технические науки

LVII Студенческая международная научно-практическая конференция «Технические и математические науки. Студенческий научный форум»
ОКСИДНЫЕ ПЛЕНКИ: ВИДЫ, МЕХАНИЗМ ОБРАЗОВАНИЯ, ЗАЩИТНЫЕ СВОЙСТВА
Аннотация. В статье рассмотрен вопрос образования оксидных пленок на поверхности железа, на основе литературного анализа определены условия, при которых пленка обладает защитными свойствами, приведен механизм образования и факторы, влияющие на сплошность.
Ключевые слова: металл, окалина, оксид, ион, пленка, железо, окислитель, реакция, окисление, объем, диффузия
Оксидная плёнка – это плёнка на поверхности металла, образующаяся при определённых условиях в воздухе или окислительной среде и состоящая из окислов этого вещества [1, с.18].
При взаимодействии металла с кислородом возникают оксидные пленки различной толщины, от свойств которых зависит дальнейший процесс окисления [2, с.10].
Образующаяся оксидная пленка может защитить металл от дальнейшего окисления, это возможно при следующих условиях:
1) сплошность пленки;
2) коэффициент теплопроводности пленки должен быть близок к коэффициенту теплопроводности металла;
3) пленка должна обладать хорошей адгезией, т.е. хорошей сцепляемостью с металлом;
4) пленка должна быть устойчивой в газовой среде;
5) соответствие кристаллической решетки пленки и металла.
Толщина образовавшихся пленок зависит от свойств металла, среды и других факторов. Толщину пленок можно подразделить на несколько видов:
а) тонкие (невидимые) толщиной от мономолекулярного слоя до 40 нм;
б) средние (видимые как цвета побежалости), имеющие толщину 40-50 нм;
в) толстые (видимые) толщиной более 500 нм.
Как уже было отмечено выше, одним из необходимых свойств, которым должны обладать оксидные пленки, способные уменьшить дальнейшее окисление металла, является их сплошность [3, с.32]. Если образующаяся окалина пориста, она не препятствует подходу окислителя к поверхности металла и скорость, тазовой коррозии не уменьшается, несмотря на образование слоев, продуктов реакции. При образовании сплошной (плотной) окалины (при температуре выше 500 °С) с момента начала реакции поверхность металла оказывается отделенной от агрессивной среды защитным слоем продуктов и дальнейшее окисление может осуществляться только путем диффузионного перемещения реагентов (ионов металла и окислителя) через окалину.
В 1923 г. Пиллинг и Бедворт сформулировали критерий (правило ПБ), согласно которому сплошная пленка продуктов коррозии будет образовываться в том случае, если объем моля образующегося оксида будет больше объема моля металла, пошедшего на образование оксида. В противном случае должна образовываться пористая (несплошная), незащитная окалина [4, с.38]:
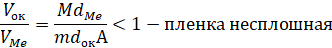

где:
 ,
,  – мольный объем оксида и металла соответственно
– мольный объем оксида и металла соответственно
М, А – молекулярная масса оксида и атомная масса металла, соответственно;
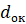 и
и 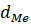 – плотность оксида и металла;
– плотность оксида и металла;
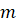 – число атомов металла в молекуле оксида.
– число атомов металла в молекуле оксида.
На поверхности железа даже при комнатной температуре в окислительной атмосфере возникает тонкий защитный слой.
Механизм образования пленки представлен на рисунке 1, из которого можно сделать вывод, что взаимодействие кислорода с поверхностью металла может происходить не только при полном отсутствии пленки, но и при очень тонкой или пористой (несплошной) пленке.
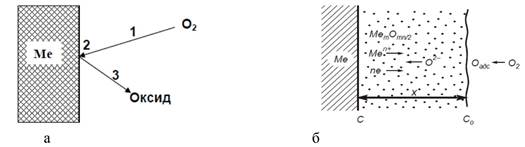
Рисунок 1. Схема взаимодействия кислорода с металлом [5, с.80]:
а – при тонкой или пористой пленке; б – при сплошной пленке
1) транспортировка О2 (в общем случае газообразного вещества) к поверхности металла;
2) адсорбция газа на поверхности метала и химическое взаимодействие;
3) отвод образующихся продуктов (образование оксида).
Если пленка сплошная, то она оказывает торможение проникновению кислорода к металлу. В случае образования сплошной пленки процесс окисления складывается из следующих стадий [5, с.79]:
а) стадия перехода металла в виде ионов и электронов в оксидный слой;
б) транспортировка ионов металла и электронов в оксидном слое;
в) транспортировка кислорода к поверхности раздела оксидная
пленка–газ;
г) адсорбция кислорода на поверхности оксидной пленки;
д) ионизация адсорбированного кислорода;
е) транспортировка ионизированного кислорода через оксидную пленку;
ж) стадия химического взаимодействия.
В зависимости от внешних условий, толщины и качества образующейся оксидной пленки скорость процесса определяется скоростью одной из этих стадий. При обычных температурах реакция окисления протекает по законам химической кинетики. С увеличением температуры скорость химической реакции быстро увеличивается, а диффузии возрастает очень медленно, в результате чего при высоких температурах скорость коррозии начинает подчиняться законам диффузии. Диффузионный характер процесса проявляется тем резче, чем толще пленка и чем она качественнее. Чем выше защитные свойства пленки, тем меньше скорость ее роста. Поэтому скорость роста пленки обратно пропорциональна толщине.
Таким образом, Пиллинг и Бедворт обосновали случай роста окалины на внутренней границе раздела фаз за счет диффузии ионов окислителя через решетку оксида. Однако в большинстве случаев решающую роль в процессе образования окалины играет диффузия ионов металла через оксидный слой. При этом образование окалины происходит не на внутренней, а на внешней границе, т.е. на границе раздела оксид-окислительная среда. Здесь пространство, которое занимает образующийся продукт, ничем не ограничено и никак не связано с объемом прореагировавшего металла [4, с.39]. Если рассматривать образование пленки при комнатной температуре, то изначально образуется гематит, далее переход идет в сторону магнетита, однако процессы, характерные для данного перехода учитывая комнатную температуру идут очень медленно. В целом же, наиболее «богатые» металлом оксиды располагаются ближе к поверхности металла, а соединения, содержащие в наибольшем количестве кислород, находятся ближе к наружной поверхности раздела оксид-кислород. Непосредственно на металле располагается слой вюстита FeO, затем идут соответственно слой магнетита Fe3O4 и гематита Fe2O3 [6, c.23].
Таким образом, в данной статье был изучен механизм образования оксидных пленок. Оксидные пленки могут образовываться даже при комнатной температуре, толщина до 40 нм (невидимы), такие пленки защищают металл от окисления, однако не препятствуют полному предотвращению поступления кислорода к поверхности металла, во многом степень защиты зависит от сплошности пленок.





