Разработка современных средств специфической профилактики природного бешенства
Конференция: V Международная заочная научно-практическая конференция «Научный форум: инновационная наука»
Секция: Сельскохозяйственные науки

V Международная заочная научно-практическая конференция «Научный форум: инновационная наука»
Разработка современных средств специфической профилактики природного бешенства
Development of modern means of specific prevention of natural rabies
Smailova Aigerim
virologist, master of agricultural science, Biotron Group, LLP, Kazakhstan, Stepnogorsk
Viktor Babak
chief of laboratory, Ph.D., candidate of veterinary sciences, Branch of RGP on PHV “National Center of Biotechnology” KN MON RK, Kazakhstan, Stepnogorsk
Irina Puntus
head of the virology department, Biotron Group, LLP,Kazakhstan, Stepnogorsk
Kuanysh Urazov
virologist, Bachelor of engineering and technology, Biotron Group, LLP, Kazakhstan, Stepnogorsk
Аннотация. В статье представлен опыт изготовления блистер-приманок для оральной иммунизации диких плотоядных животных против бешенства. Разработанные блистер-приманки на основе мясокостной и пшеничной муки хорошо поедаются плотоядными животными и соответствуют требованиям к приманкам для орального применения. В приманочную массу помещается полипропиленовый блистер, который содержит 2,0 см3 антирабической вирусвакцины штамма BGCM-V01. Поедаемость блистер-приманок в природных условиях составила 80,2–91,5%.
Abstract. In the article it is presented the experience of manufacturing of the blister-baits for oral immunization of wild carnivores against the rabies. The work out blister-baits basis on meat-bone and wheat flour are well eaten by carnivores and correspond to the requirements to the baits for oral use. In the bait mass is seated the polypropylene blister which contain 2,0 sm3 antirabic virusvaccine the strain BGCM-V01. Palatability of the blister-baits in the natural conditions has compounded about 80,2-91,5 percent.
Ключевые слова: культура клеток; приманка; вирусвакцина; иммуногенность; биореактор.
Keywords: cell culture; bait; virusvaccine; immunogenicity; bioreactor.
Бешенство (лат. Rabies) представляет большую угрозу здоровью животных и человека. Несмотря на достижения современной науки в изучении болезни, заболевание имеет выраженную тенденцию к распространению, особенно в природном резервуаре, в ряде стран увеличивается количество животных больных бешенством и случаи заражения людей [1].
Бешенство относится к группе наиболее опасных инфекционных заболеваний теплокровных животных и человека, характеризующегося поражением центральной нервной системы [2,4].
Заболевание наносит серьезный экономический ущерб. По оценке Всемирной организации здравоохранения (ВОЗ) экономический ущерб мировой экономике от бешенства превышает 1 миллиард долларов в год, и складывается из убытков, связанных с гибелью животных и людей, а также затрат на проведение ограничительных и профилактических мероприятий [3].
Сложная ситуация по бешенству сохраняется в Азии, где основным резервуаром и переносчиком заболевания являются собаки и кошки – доминирует городской тип бешенства. На Азиатский регион приходится большинство зарегистрированных в мире случаев бешенства у человека (до 37 тысяч случаев) и животных. На Африканском континенте бешенство быстро развивается среди популяций диких животных: шакалов и гиен. Резервуаром инфекции, по данным Edelsten R.M. (1995), Bingham J. et al. (1999) остаются собаки – 45–90% случаев, представляющие угрозу человеку и сельскохозяйственным животным [4].
Современная ситуация по бешенству на Американском континенте характеризуется как чрезвычайно сложная и постоянно меняющаяся, особенно в странах Латинской Америки. Основным резервуаром бешенства в Северной Америке остаются собаки (60%), но не менее важную роль играют рукокрылые (20% и более). В Канаде и Аляске лесная форма бешенства поддерживается лисами, в США – скунсами и енотами, которые являются источником вируса для домашних и бездомных собак и кошек [3; 7].
По данным ряда зарубежных авторов (Aubert M.F., Muller Т., Vos A., Linhart S.B., King R., Neubert, A. Schluter, H., Holmala K., Wandeler, A.I.) за последние десятилетия ситуация по бешенству в Западной и Центральной Европе значительно изменилась [11]. Благодаря вакцинации домашних животных и уничтожению волков и бродячих собак ряд европейских стран ликвидировал собачье бешенство. В целях предотвращения распространения природного бешенства в Европе развернулась кампания по борьбе с бешенством диких плотоядных, что позволило элиминировать бешенство даже в ситуации роста их популяции. В целом из 40 государств, приславших в ВОЗ информацию, бешенство зарегистрировано в 26, а 14 стран (Бельгия, Великобритания, Норвегия, Швеция, Исландия, Ирландия, Греция, Португалия, Люксембург, Чехия, Италия, Македония, Испания, Кипр) свободны от этой инфекции (RBE, 4/2003) [10; 11].
Сильватическое бешенство весьма разнообразно, и зависит от многообразия циркулирующих в очаге видов животных, их биологических особенностей, плотности популяции, от миграции диких плотоядных, являющихся основным резервуаром бешенства в природе, площади лесных массивов и других факторов. В настоящее время все чаще рассматривается «европейская модель» рабической инфекции, при которой первичным и основным источником и резервуаром бешенства является обыкновенная лисица (Vulpes vulpes). Кроме того, на территории Евразии эпизоотическую ситуацию по бешенству определяют волк, енотовидная собака, песец, шакал как типичные хищные плотоядные животные [7; 8].
Вакцинопрофилактика бешенства занимает ведущее место в борьбе с этим заболеванием. Для специфической профилактики применяются как живые, так и инактивированные вакцины. Оральная вакцинация является основным способом борьбы с бешенством в дикой природе – в резервуаре инфекции. С помощью оральной вакцинации было ликвидировано заболевание наземных млекопитающих в большинстве стран Западной Европы [5].
Живые вакцины против бешенства животных представляют собой приманку, привлекательную для диких плотоядных, в которую помещают вирусвакцину. Разработка оральных антирабических вакцин в виде приманок, содержащих живой аттенуированный фиксированный вирус бешенства, позволит эффективно решать проблему специфической профилактики бешенства. Фиксированные штаммы имеют большое значение как объект научного изучения и практического использования [5; 6; 9].
Материалы и методы
В качестве биоматериала для изготовления вирус вакцины использовали фиксированный штамм вируса бешенства Rabies virus fix BGCM-V01.
Вакцинный вирус культивировали на перевиваемой культуре клеток ВНК–21(сl-13) на питательных средах DMEM (среда Игла модифицированная Дюльбеко) и ФГМ-С (ферментативный гидролизат мышечных белков), в качестве подпитки служили растворы L-глютамина, В-глюкозы и гамма-облученная сыворотка крови крупного рогатого скота.
Первичную расплодку клеток ВНК-21(сl–13) накапливали роллерным способом в стационарном монослое и суспензионным в биореакторе Biostat-В (рабочий объем до 5 л). Биомассу вируса бешенства накапливали способом заражения на растущую клетку и глубинным суспензионным способом на лабораторном биореакторе Biostat-В.
До фасовки вакцины инфекционную активность вирусного сырья определяли методом титрации на белых мышах массой 6–8 г при интрацеребральном заражении дозой 0,03 мл. Учет результатов титрования на мышах проводили с 5 по 14 сутки после заражения на основании клинических признаков и гибели животных. Расчет титра вируса проводили по методу Кербера в модификации Ашмарина и выражали в lg МЛД50/мл.
Безвредность вирусвакцины проверяли на собаках.
Биомассу вируса после составления с компонентами вакцины фасовали в полистирольные или полипропиленовые блистеры объемом 2,0+0,2 или 3,0+0,3см3, покрытые с одной стороны алюминиевой фольгой.
Для изготовления оральных приманок отрабатывалась рецептура из следующих компонентов: мясокостная мука, пшеничная мука, глицерин, желатин, вода, тетрациклина гидрохлорид. Образцы готовились путем смешения компонентов приманки и фасовки/розлива в одноразовые полистирольные контейнер-формы по 18, 22 или 28 приманки.
Показатели качества блистер-приманок определяли по линейному размеру, формы, массе, цвету, запаху, прочности и структуры материала через 5 дней после приготовления и через 6 месяцев хранения.
Линейные параметры приманок вакциносодержащих, оценивали визуально и с помощью измерительных приборов. Определение внешнего вида, цвета, наличия посторонних примесей в вакцине в блистере проводили тщательно просматривая блистер в проходящем свете, и после отбора вакцины из блистера. Также, оценивали объем вакцины и рН вакцины в блистере.
Показатель поедаемости оценивали на 15 собаках после 16 часовой голодной диеты.
Результаты исследований.
Для конструирования вакцины использовали биомассу штамма вируса бешенства Rabies virus fix BGCM-V01 с инфекционной активностью от 6,25 до 7,0 lg МЛД50/мл.
Нами были использованы образцы приманок разной рецептуры приведенные в таблице 1.
Таблица 1.
Серии приманок антирабических для диких плотоядных животных
|
Компоненты приманки |
Рецептура |
||||
|
№1 |
№2 |
№3 |
№4 |
№5 |
|
|
мясокостная мука |
18 |
20 |
16 |
16 |
- |
|
пшеничная мука |
18 |
20 |
10 |
25 |
6 |
|
рыбная мука |
- |
- |
6 |
- |
26 |
|
глицерин |
12 |
– |
12 |
4 |
12 |
|
вода |
51,5 |
50 |
46 |
50 |
46 |
|
желатин |
– |
9,5 |
9,5 |
3 |
5,5 |
|
кровь КРС |
- |
- |
- |
4 |
4 |
|
тетрациклина гидрохлорид |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
Приманки, полученные в серии №1, не содержащие вспомогательный формообразующий компонент желатин после удаления из контейнер-формы и разморозки теряли исходную форму, были мягкие. Приманки, в которых исключили вспомогательный формообразующий компонент глицерин (серия №2), перемерзали при хранении и такие приманки имели слабый запах мясокостной муки, что сказалось на их привлекательности для животных. Отсутствие глицерина в рецептуре приманки сказывалось также на вязкости приманочной массы, разогретой до температуры 45-55°С. Серии №3 и №5 содержат в составе рыбную муку, они хорошо поедались в опыте, но результат был несколько хуже, чем в рецептуре серии №4.
Наиболее оптимальными были приманки, полученные в серии №4 при следующем соотношении компонентов, мас.%: мясокостная мука – 16, пшеничная мука – 25, глицерин – 4, желатин – 3, кровь – 4, вода – 50, тетрациклина гидрохлорид – 0,5.
При исследовании приманок, отобранных из лабораторных серий (15 штук), нами установлены следующие параметры:
· Линейные размеры: диаметр 4,0-4,5 см, высота 1,8-2,0 см;
· Форма приманки – шайбообразная;
· Масса – Δ31,5-2,1 г;
· Цвет приманок – от светло-коричневого до темно-коричневого в разных сериях;
· Запах – специфический, стойкий, сохраняющийся после размораживания, с преобладанием запаха мясокостной муки;
· Структура материала – свежие и хранившиеся в приманке упругие, резиноподобные, прочные, умеренно твердые, целостные, без трещин.
Исследуемые блистеры с вакциной, извлеченные из приманок, имели следующие показатели:
· полипропиленовый блистер объемом 2,0+0,2см3, покрытый с одной стороны алюминиевой фольгой;
· вакцина в блистере – жидкость розового цвета различной интенсивности;
· объем содержимого блистера – 1,9+0,1см3 вакцины;
· наличие посторонних примесей в вакцине – не выявлено;
· значение рН – 6,95–7,32.
Предложенная нами рецептура приманки №4 является достаточно простой, но, в то же время, она отвечает ряду требований к приманкам для оральной иммунизации [5; 9]. Мясокостная мука обеспечивает запах, привлекательный для животных и вызывает желание поедать данные приманки. Запах мясокостной муки сохраняется достаточно долго, что согласуется со сроком хранения приманок и вирусвакцины – 12 месяцев. Клейковина пшеничной муки и желатин формируют требуемую структуру и прочность приманки. Если материал приманки будет слишком мягкий, животное может воспринять твердый блистер с вакциной как посторонний предмет и выплюнуть его, а очень твердый материал приманки не позволит её разжевать. Глицерин не дает замерзать приманкам, при этом они не теряют своего запаха на морозе, что влияет на поедаемость приманок животными. Кроме того, глицерин обеспечивает умеренную вязкость горячей приманочной массы, что улучшает ее текучесть при розливе в контейнер-формы. Тетрациклина гидрохлорид, откладываясь в костях и зубах животных, является биомаркером поедаемости приманок. Определение тетрациклина гидрохлорида в зубах лисиц имеет диагностическое значение.
Структура материала приманок позволяет сохранять форму и прочность в умеренно влажных природных условиях в течение 7–10 дней (срок наблюдения).
Компоненты приманок №4 являются экономически доступными и рентабельными для производства вакцины. Разработанные нами блистер-приманки представлены на рисунке 1.

Рисунок 1. Блистер-приманки и блистеры с вакциной
В природных условиях в осенний период поедаемость приманок дикими животными составила 91,5%, в зимний период – 80,2%. На оставшиеся 8,5–19,8% пришлись не съеденные, недоеденные блистер-приманки и мало разжеванные блистеры с вакциной. Найденные разжеванные пустые блистеры свидетельствуют о попадании вирусвакцины в ротовую полость животных – рисунок 2.
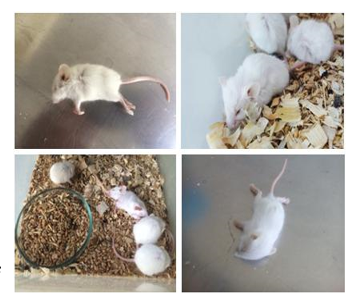
Рисунок 2. Разжеванные блистеры без вакцины
При титровании вируса бешенства у заболевших мышей отмечались типичные клинические признаки бешенства не ранее, чем на 4-й день после заражения: взъерошенность шерсти, параличи, парезы, коматозное или возбужденное состояние, зарывание в подстилку - рисунок 3.

Рисунок 3. Типичные клинические признаки бешенства у зараженных мышей при определении инфекционной активности вируса
Иммуногенную активность вакцины определяли через 26 дней после иммунизации. У шести собак отобрали пробы сыворотки крови для постановки реакции вируснейтрализации на белых мышах с постоянной дозой вируса CVS 100 МЛД50/0,03 мл. Собаки, получившие по одной приманке с антирабической вакциной, имели ВНА к вирусу бешенства в титрах 3,80–5,20 log2 (4,44+0,38 log2) или от 1:14 до 1:36,8, что свидетельствует о формировании напряженного иммунитета.
Безвредность. Собаки поедали до 5–7 приманок без блистеров и по 2–3 приманки с блистерами, заправленными вакциной. Распознавая инородный предмет в приманке (капсулу с вакциной), животные с меньшим аппетитом поедали следующие приманки. Разжевывание блистеров было удовлетворительным, и способствовало попаданию вакцины в ротовую полость собак.
Выводы
1. Разработана вирусвакцина антирабическая в блистер-приманках для пероральной иммунизации диких плотоядных животных для специфической профилактики бешенства в природном резервуаре.
2. Разработана оптимальная рецептура приманочной массы для изготовления блистер-приманок, со следующим соотношением основных, вспомогательных и формообразующих компонентов, мас.%: мясокостная мука – 16, пшеничная мука – 25, глицерин – 4, желатин – 3, кровь – 4, вода – 50, тетрациклина гидрохлорид – 0,5.
3. Проведены лабораторные испытания вакцины на поедаемость, безвредность, стабильность, проверена инфекционная активность и иммуногенная активность вакцины, которая составила 6,25–7,0 lg МЛД50/мл и 3,80–5,20 log2 соответственно.


