КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ ОКСИДОВ ЭРБИЯ И ЛЮТЕЦИЯ В РЕАКЦИИ ИЗОТОПНОГО ОБМЕНА МЕЖДУ УГЛЕКИСЛЫМ ГАЗОМ И ПАРАМИ ВОДЫ
Конференция: LXIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Неорганическая химия

LXIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ ОКСИДОВ ЭРБИЯ И ЛЮТЕЦИЯ В РЕАКЦИИ ИЗОТОПНОГО ОБМЕНА МЕЖДУ УГЛЕКИСЛЫМ ГАЗОМ И ПАРАМИ ВОДЫ
CATALYTIC ACTIVITY OF OXIDES OF ERBIUM AND LUTETIUM IN THE REACTION OF ISOTOPE EXCHANGE BETWEEN CARBON DIOXIDE AND WATER VAPOR
Ivan Vorakso
PhD student, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Irina Rastunova
Doctor of Technical Science, assistant professor, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Alexander Chebotov
Assistant, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Vitaliy Shimko
Student, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Vera Belova
Doctor of Chemical Science, Leading Researcher, Kurnakov Institute of General and Inorganic Chemistry, Russia, Moscow
Аннотация. В статье представлены результаты определения каталитической активности синтезированных катализаторов на основе оксидов эрбия и лютеция, нанесённых на носитель – гамма оксид алюминия. Также приведены результаты исследования поверхности полученных катализаторов методами рентгенофлуоресцентного анализа, сканирующей электронной микроскопии и анализа удельной поверхности и пористости методом низкотемпературной адсорбции азота.
Abstract. The article presents the results of determining the catalytic activity of synthesized catalysts based on oxides of erbium and lutetium deposited on a carrier – gamma aluminium oxide. The results of studying the surface of the obtained catalysts using X-ray fluorescence analysis, scanning electron microscopy, and analysis of specific surface area and porosity using low-temperature nitrogen adsorption are also presented.
Ключевые слова: изотопы; химический изотопный обмен; система вода – углекислый газ; гетерогенный катализ.
Keywords: isotopes: chemical isotope exchange; water – carbon dioxide system; heterogenous catalysis.
Введение
В природе химический элемент кислород встречается в виде смеси трёх стабильных изотопов: с массовыми числами 16 (99,759 ат. %), 17 (0,037 ат. %) и 18 (0,204 ат. %) [1]. В последние годы широкое применение получил самый тяжёлый из них – 18О. Его применяют для синтеза радиофармпрепаратов на основе β+-активного изотопа фтора-18 [2,3]. Также кислород-18 используется в качестве изотопной метки во многих областях науки: геологии, биологии, химии и т.д. [1, 4].
Ввиду широкого применения продукции с изменённым по кислороду изотопным составом, задача разделения изотопов кислорода является актуальной. С термодинамической точки зрения перспективной системой для разделения изотопов кислорода является химический изотопный обмен (ХИО) между углекислым газом и водой. Данная система характеризуется практически на порядок большими значениями коэффициента обогащения по сравнению с ректификацией воды под вакуумом [5].
Поиск эффективного гетерогенного катализатора для реакции изотопного обмена между углекислым газом и парами воды может обеспечить создание более экономичных установок разделения изотопов кислорода. В настоящее время для реакций с участием углекислого газа широко распространены катализаторы на основе оксидов редкоземельных элементов (РЗЭ), и в прошлых работах были исследованы катализаторы на основе оксидов лантана, церия, празеодима, европия и гадолиния [6]. В данной работе представлено исследование катализаторов на основе оксидов эрбия и лютеция, которое продолжает ряд исследований оксидов РЗЭ.
Методы
Синтез катализаторов осуществлялся методом пропитки носителя водным раствором нитрата эрбия или лютеция с последующим термическим разложением соли на поверхности носителя в атмосфере воздуха. В качестве носителя использовали гранулированный γ-Al2O3 производства Hong Kong Chemical Corporation – сферические гранулы диаметром 3-5 мм. Данный тип носителя хорошо себя зарекомендовал в катализе. В результате термического разложения нитратов РЗЭ на поверхности носителя наносится оксид соответствующего металла, а образовавшиеся молекулярный кислород и диоксид азота улетучиваются.
Структура поверхности синтезированных образцов катализаторов была изучена методами сканирующей электронной микроскопии (СЭМ), рентгенофлуоресцентного анализа (РФА) и анализа удельной поверхности и пористости методом низкотемпературной адсорбции азота (ASAP) в центре коллективного пользования имени Д.И. Менделеева. СЭМ-изображения поверхности образца Er2O3/Al2O3 представлены на рисунке 1, а Lu2O3/Al2O3 – на рисунке 2.


Рисунок 1. СЭМ-изображение поверхности Er2O3/Al2O3


Рисунок 2. СЭМ-изображение поверхности Lu2O3/Al2O3
По СЭМ-изображениям виден принципиально разный характер покрытия оксидами РЗЭ поверхности оксида алюминия. Результаты определения химического состава поверхности, а также ее площади и пористости представлены в таблице 1.
Таблица 1.
Характеристики поверхности образцов катализаторов
|
Характеристика |
Катализатор |
|
|
Er2O3/Al2O3 |
Lu2O3/Al2O3 |
|
|
Соотношение оксид РЗЭ : оксид алюминия, мол. % : мол. % |
61,7 : 38,3 |
79,3 : 20,7 |
|
Удельная поверхность, м2/г |
126 |
124 |
|
Общий объём пор, см3/г |
0,21 |
0,22 |
|
Средний диаметр пор, нм |
7,3 |
7,3 |
Несмотря на то, что оксид лютеция лучше закрепился на поверхности носителя (методика приготовления была идентичной) геометрическая структура поверхности обоих образов оказалась одинаковой.
Результаты
Исследования каталитической активности образцов проводили в динамическом режиме, пропуская реакционную смесь углекислого газа и паров воды через реактор, в который помещался исследуемый катализатор. В экспериментах использовали углекислый газ природного изотопного состава и воду с изотопной меткой 18О. Изотопный анализ реагентов и продуктов реакции проводили масс-спектрометрическим методом. Обработку экспериментальных данных проводили по уравнению кинетики первого порядка [5], т.к. практически все реакции изотопного обмена описываются этим уравнением:
 , (1)
, (1)
где k – наблюдаемая константа скорости, с-1; F – степень обмена; τ – время контакта реакционной смеси с катализатором.
Степень обмена рассчитывали, как:
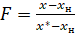 , (2)
, (2)
где x* - концентрация 18О в углекислом газе, равновесная концентрации 18О в парах воды, выходящих из каталитического реактора; х – концентрация 18О в углекислом газе, выходящем из каталитического реактора; хн - концентрация 18О в углекислом газе, входящем в каталитический реактор.
Далее рассчитывали скорость суммарного изотопного обмена (моль/(м3∙с)):
 , (3)
, (3)
где n, m – числа обменивающихся атомов в углекислом газе и воде, соответственно; nA, nB – концентрация углекислого газа и водяного пара в реакционной смеси (моль/м3).
Эксперименты проводились при температуре 348 К, давлении 0,1 МПа и мольном отношении потоков углекислого газа и паров воды λ=8,2. В реактор помещалась навеска катализатора объёмом 3 см3. За один эксперимент проводилось 5 отборов проб. Результаты определения активности исследованных в данной работе катализаторов представлены в таблице 2.
Таблица 2.
Каталитическая активность оксидов эрбия и лютеция, нанесённых на оксид алюминия, в реакции изотопного обмена между углекислым газом и парами воды
|
Образец |
Температура в реакторе, Тр-р, К |
Степень обмена F |
Наблюдаемая константа скорости |
Скорость изотопного обмена Rио, моль/(м3·с) |
|
Er2O3/Al2O3 |
348 |
0,179 |
0,771±0,063 |
4,72±0,38 |
|
Lu2O3/Al2O3 |
0,140 |
0,597±0,040 |
3,66±0,25 |
Оксид эрбия, нанесённый на оксид алюминия, проявляет немного большую каталитическую активность по сравнению с образцом Lu2O3/Al2O3. Близкие к полученным в данной работе значения каталитической были получены ранее для образов на основе оксидов лантана и церия [6]. Абсолютные значения наблюдаемой константы скорости не велики, однако оксиды эрбия и лютеция можно рассматривать в будущем для синтеза высокоэффективных катализаторов изотопного обмена между углекислым газом и парами воды сложного состава.
Благодарность: Работа выполнена в рамках программы развития РХТУ им. Д.И. Менделеева «Приоритет 2030».


