КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ ОКСИДОВ ИТТРИЯ И РЯДА РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ В РЕАКЦИИ ИЗОТОПНОГО ОБМЕНА МЕЖДУ УГЛЕКИСЛЫМ ГАЗОМ И ПАРАМИ ВОДЫ
Конференция: LXIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Неорганическая химия

LXIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ ОКСИДОВ ИТТРИЯ И РЯДА РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ В РЕАКЦИИ ИЗОТОПНОГО ОБМЕНА МЕЖДУ УГЛЕКИСЛЫМ ГАЗОМ И ПАРАМИ ВОДЫ
CATALYTIC ACTIVITY OF OXIDES OF YTTRIUM AND A NUMBER OF RARE EARTH METALS IN THE REACTION OF ISOTOPE EXCHANGE BETWEEN CARBON DIOXIDE AND WATER VAPOR
Ivan Vorakso
PhD student, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Irina Rastunova
Doctor of Technical Science, assistant professor, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Alexander Chebotov
Assistant, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Diana Maryanyan
Student, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Vera Belova
Doctor of Chemical Science, Leading Researcher, Kurnakov Institute of General and Inorganic Chemistry, Russia, Moscow
Аннотация. В статье представлены результаты определения каталитической активности синтезированных катализаторов на основе оксидов иттрия, тербия, диспрозия и гольмия, нанесённых на носитель – гамма оксид алюминия. Также приведены результаты исследования поверхности полученных катализаторов методами рентгенофлуорисцентного анализа, сканирующей электронной микроскопии и анализа удельной поверхности и пористости методом низкотемпературной адсорбции азота.
Abstract. The article presents the results of determining the catalytic activity of synthesized catalysts based on oxides of yttrium, terbium, dysprosium and holmium deposited on a carrier – gamma aluminium oxide. The results of studying the surface of the obtained catalysts using X-ray fluorescence analysis, scanning electron microscopy, and analysis of specific surface area and porosity using low-temperature nitrogen adsorption are also presented.
Ключевые слова: изотопы; химический изотопный обмен; система вода – углекислый газ; гетерогенный катализ.
Keywords: isotopes; chemical isotope exchange; water – carbon dioxide system; heterogenous catalysis.
Введение
Основным промышленным методом разделения изотопов кислорода является ректификация воды под вакуумом. Данный метод имеет ряд существенных преимуществ по сравнению с другими методами: неограниченность сырья и простота технологического оборудования. Однако, с точки зрения термодинамики, наиболее перспективным методом разделения изотопов кислорода является химический изотопный обмен (ХИО) между углекислым газом и водой. Данная система характеризуется практически на порядок большим значением коэффициента обогащения по сравнению с вакуумной ректификацией воды (ε=0,0465÷0,0292 при Т=278÷373 К для ХИО против ε=0,0078÷0,0058 при Т=323÷353 К для ректификации). Такое различие позволяет значительно сократить перерабатываемые сырьевые потоки, что снижает металлоёмкость оборудования [1].
Реакция изотопного обмена между углекислым газом (3) и водой требует активации катализатором. В случае использования гетерогенных катализаторов процесс идёт в 2 стадии: каталитический изотопный обмен (КИО) между углекислым газом и парами воды (1) на активных центрах катализатора и фазовый изотопный обмен (ФИО) между жидкой водой и её парами (2).
 (КИО) (1)
(КИО) (1)
 (ФИО) (2)
(ФИО) (2)
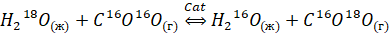 (ХИО) (3)
(ХИО) (3)
При использовании гетерогенного катализатора важно не допускать блокировки его активных центров жидкой водой, для чего можно использовать гидрофобные катализаторы [2] или проводить процесс в контактном устройстве, в котором катализатор пространственно отделён от потока жидкой воды, такое как, например, контактное устройство мембранного типа (КУМТ) [3]. В настоящее время для проведения реакций с участием углекислого газа часто используют катализаторы на основе оксидов редкоземельных элементов (РЗЭ) [4], поэтому в данной работе представлено исследование активности катализаторов на основе оксидов иттрия, тербия, диспрозия и гольмия в реакции изотопного обмена между углекислым газом и парами воды.
Методы
Синтез катализаторов осуществлялся методом пропитки носителя водным раствором нитратов металлов с последующим термическим разложением соли на поверхности носителя в атмосфере воздуха. В качестве носителя использовали пористый γ-Al2O3 (производитель – Hong Kong Chemical Corporation) – сферические гранулы диаметром 3-5 мм. Данный тип носителя хорошо себя зарекомендовал в катализе. В результате термического разложения нитратов металлов на поверхности носителя остаётся оксид соответствующего элемента, а образовавшиеся молекулярный кислород и диоксид азота улетучиваются.
Структура поверхности синтезированных образцов катализаторов была изучена методами сканирующей электронной микроскопии (СЭМ), рентгенофлуоресцентного анализа (РФА) и анализа удельной поверхности и пористости методом низкотемпературной адсорбции азота (ASAP) в центре коллективного пользования имени Д.И. Менделеева. СЭМ-изображения поверхности образца Tb4O7/Al2O3 представлены на рисунке 1, Dy2O3/Al2O3 – на рисунке 2, Ho2O3/Al2O3 – на рисунке 3, а Y2O3/Al2O3 – на рисунке 4. По снимкам поверхности видно, что оксиды лантаноидов образовали на поверхности оксида алюминия в целом похожие друг на друга и на чистый оксид алюминия [5] структуры, тогда как оксид иттрия образовал вытянутые кристаллы.


Рисунок 1. СЭМ-изображение поверхности Tb4O7/Al2O3


Рисунок 2. СЭМ-изображение поверхности Dy2O3/Al2O3


Рисунок 3. СЭМ-изображение поверхности Ho2O3/Al2O3


Рисунок 4. СЭМ-изображение поверхности Y2O3/Al2O3
Результаты определения химического состава поверхности, а также ее площади и пористости представлены в таблице 1.
Таблица 1.
Характеристики поверхности образцов катализаторов
|
Характеристика |
Катализатор |
|||
|
Tb4O7/Al2O3 |
Dy2O3/Al2O3 |
Ho2O3/Al2O3 |
Y2O3/Al2O3 |
|
|
Соотношение оксид металла : оксид алюминия, мол. % : мол. % |
12,3 : 87,7 |
25,6 : 74,4 |
15,3 : 84,7 |
93,6 : 6,4 |
|
Удельная поверхность, м2/г |
142 |
138 |
136 |
138 |
|
Общий объём пор, см3/г |
0,19 |
0,17 |
0,18 |
0,24 |
|
Средний диаметр пор, нм |
6,5 |
6,5 |
6,8 |
7,7 |
Из данных таблицы видно, что оксиды тербия, диспрозия и гольмия гораздо хуже закрепились на поверхности носителя по сравнению с оксидом иттрия, хотя концентрации растворов прекурсоров были одинаковыми.
Результаты
Исследования каталитической активности образцов проводили в динамическом режиме, пропуская реакционную смесь углекислого газа и паров воды через реактор, в который помещался исследуемый катализатор. В экспериментах использовали углекислый газ природного изотопного состава и воду с изотопной меткой 18О. Изотопный анализ реагентов и продуктов реакции проводили масс-спектрометрическим методом. Обработку экспериментальных данных проводили по уравнению кинетики первого порядка [5], т.к. практически все реакции изотопного обмена описываются этим уравнением:
 , (1)
, (1)
где k – наблюдаемая константа скорости, с-1; F – степень обмена; τ – время контакта реакционной смеси с катализатором.
Степень обмена рассчитывали, как:
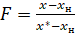 , (2)
, (2)
где x* - концентрация 18О в углекислом газе, равновесная концентрации 18О в парах воды, выходящих из каталитического реактора; х – концентрация 18О в углекислом газе, выходящем из каталитического реактора; хн - концентрация 18О в углекислом газе, входящем в каталитический реактор.
Далее рассчитывали скорость суммарного изотопного обмена (моль/(м3∙с)):
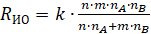 , (3)
, (3)
где n, m – числа обменивающихся атомов в углекислом газе и воде, соответственно; nA, nB – концентрация углекислого газа и водяного пара в реакционной смеси (моль/м3).
Эксперименты проводились при температуре 348 К, давлении 0,1 МПа и мольном отношении потоков углекислого газа и паров воды λ=8,2. В реактор помещалась навеска катализатора объёмом 3 см3. За один эксперимент проводилось 5 отборов проб. Результаты определения активности исследованных в данной работе катализаторов представлены в таблице 2.
Таблица 2.
Каталитическая активность оксидов эрбия и лютеция, нанесённых на оксид алюминия, в реакции изотопного обмена между углекислым газом и парами воды
|
Образец |
Температура в реакторе, Тр-р, К |
Степень обмена F |
Наблюдаемая константа скорости |
Скорость изотопного обмена Rио, моль/(м3·с) |
|
Tb4O7/Al2O3 |
348 |
0,069 |
0,280±0,026 |
1,72±0,16 |
|
Dy2O3/Al2O3 |
0,052 |
0,210±0,024 |
1,29±0,15 |
|
|
Ho2O3/Al2O3 |
0,062 |
0,251±0,020 |
1,54±0,12 |
|
|
Y2O3/Al2O3 |
0,199 |
0,870±0,051 |
5,33±0,31 |
Оксиды тербия, диспрозия и гольмия, нанесённые на оксид алюминия, практически не катализируют исследуемую реакцию. Однако образец Y2O3/Al2O3 показывает значительно более высокие значения каталитической активности. Вероятно, это связано с тем, что оксид иттрия лучше закрепился на поверхности носителя (см. табл. 1). Близкие к полученным в данной работе значения каталитической были получены ранее для образов на основе оксидов лантана и церия [5]. Абсолютные значения наблюдаемой константы скорости не велики, однако оксид иттрия можно рассматривать в будущем для синтеза высокоэффективных катализаторов изотопного обмена между углекислым газом и парами воды сложного состава.
Благодарность: Работа выполнена в рамках программы развития РХТУ им. Д.И. Менделеева «Приоритет 2030».

