Разработка one-pot процедуры получения симметричных защищенных и свободных бис(α-амино)фосфиновых кислот и моделирование их свойств
Конференция: XX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Химия элементоорганических соединений

XX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Разработка one-pot процедуры получения симметричных защищенных и свободных бис(α-амино)фосфиновых кислот и моделирование их свойств
Development of one-pot procedures for obtaining symmetric protercted and non-protected phosphinic acid and modeling of their properties
Andrey Starikov
graduate student Institute of Physiologically Active Compounds RAS, Russia, Chernogolovka
Alexey Vinyukov
Researcher, Cand. chemical sciences, Institute of Physiologically Active Compounds RAS, The Institute of Problems of Chemical Physics RAS, Russia, Chernogolovka
Alexey Borodachev
Junior Researcher Institute of Physiologically Active Compounds RAS, Russia, Chernogolovka
Daniil Polianchik
Junior Researcher Institute of Physiologically Active Compounds RAS, Russia, Chernogolovka
Работа выполнена при финансовой поддержке грантов РФФИ № 18-33-00643 и 18-03-01123.
Аннотация. Изучение и терапия ВИЧ в настоящее время является одной из приоритетных задач для современной медицины. В связи с чем, поиск новых физиологически активных веществ и удобных процедур для их получения является одним из самых важных направлений для органической химии. Бис(α-аминоалкил)фосфиновые кислоты симметричного строения, как известно, являются эффективными ингибиторами ВИЧ-1 протеазы, а также полупродуктами для получения ряда непептидных аналогов ингибитора ВИЧ-1 протеазы циклического строения. Однако, на данный момент не существует удобной процедуры для их получения. Настоящая работа направлена на разработку методики двойного амидоалкилирования гидрофосфорильных соединений и удобной one-pot процедуры получения бис(α-аминоалкил)фосфиновых кислот симметричного строения, являющихся потенциальными ингибиторами ВИЧ-1 протеазы.
Abstract. The study and treatment of HIV is currently one of the priority problems of modern medicine. Therefore, the search for new physiologically active compounds, and convenient procedures to obtain them is one of the most important areas in organic chemistry. Bis(α-aminoalkyl)phosphinic acid symmetrical structure, as is known, are effective inhibitors of HIV-1 protease, as well as intermediates for a number of non-peptide analogues of the inhibitor of HIV-1 protease with cyclic structure. However, at the moment there is no convenient procedure to obtain them. The present work aims to develop a convenient one-pot procedures for obtaining
bis(α-aminoalkyl)phosphinic acid symmetrical structure, which are inhibitors of HIV-1 protease.
Ключевые слова: ингибиторы ВИЧ-1 протеазы; амидоалкилирование гидрофосфорильных соединений; фосфиновые кислоты; двойное амаидоалкилирование.
Keywords: inhibitors of HIV-1 protease; amidoalkylation of hydrophosphoryl compounds; phosphinic acid; double amidoalkylation.
Изучение и терапия ВИЧ в настоящее время является одной из приоритетных задач для современной медицины. В связи с чем, поиск новых физиологически активных веществ и удобных процедур для их получения является одним из самых важных направлений для органической химии. Не так давно стало известно о том, что симметричные бис(α-аминоалкил)фосфиновые кислоты могут быть использованы как сами по себе, так и в качестве полупродуктов, как непептидные аналоги ингибитора ВИЧ-1 протеазы. Однако на данный момент не существует удобной процедуры для их получения. В связи с чем, работа, в рамках настоящего проекта, направлена на разработку новой удобной one-pot процедуры синтеза симметричных N-защищенных бис(α-аминоалкил)фосфиновых кислот и их дальнейшая циклизация. Кроме того, анализ литературы показал, что сведения по двойному амидоалкилированию гидрофосфорильных соединений с получением C2-симметричных фосфиновых кислот, практически отсутствуют. Получение бис(α-аминоалкил)фосфиновых кислот ранее достигалось посредством сложных многостадийных процедур синтеза. В связи с чем, в настоящее время актуальной становится разработка новых более удобных и дешевых процедур синтеза бис(α-аминоалкил)фосфиновых кислот, которые в свою очередь могут быть использованы как непептидные аналоги ингибитора ВИЧ-1 протеазы [1-5].
На данный момент существует целый ряд ингибиторов ВИЧ-1 протеазы (индинавир, саквинавир), рекомендованных к использованию при терапии ВИЧ. Механизм их действия заключается во встраивании в активный участок фермента, препятствуя тем самым расщеплению полипротеина Gag-Pol на отдельные белки и последующему созреванию вирусных частиц, которые становятся не способны заражать новые клетки. Научная группа Гробельного смогла показать, что фосфиновые кислотные изостеры гексапептидов являются мощными ингибиторами протеазы ВИЧ [1]. Одним из известных классов ингибиторов протеазы являются C2-симметричные ингибиторы ВИЧ-протеаз типа 1a, 1b [2-4] и 1c [5] (Рисунок 1).
Конкретной фундаментальной задачей настоящей работы являлась разработка универсальной one-pot процедуры двойного амидоалкилирования гидрофосфорильных соединений, позволяющей построить две фосфор-углеродных связи с сохранением защитных групп при атоме азота. Данная процедура позволит осуществить синтез N-защищенных бис(α-аминоалкил)фосфиновых кислот, являющихся фосфиновыми биоизостерными аналогами ингибитора ВИЧ-1 протеазы, путем двойного амидоалкилирования гидрофосфорильных соединений, а их дальнейшая циклизация, позволит получить ряд непептидных циклических аналогов ингибитора ВИЧ-1 протеазы.
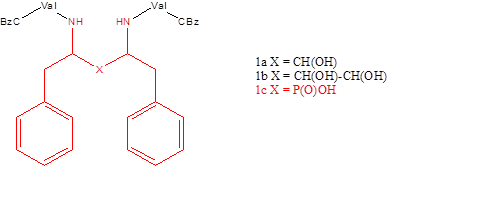
Рисунок 1. Ингибиторы ВИЧ-1 протеазы
На первой стадии представленной работы мы использовали данные исследований трехкомпонентной карбаматной версии реакции Кабачника-Филдса, проведенных ранее в нашей лаборатории [6-8], для создания удобной одностадийной процедуры двойного амидоалкилирования гидрофосфорильных соединений на примере гипофосфористой кислоты [9]. В результате нам удалось получить и выделить ряд симметричных N-защищенных бис(α-аминоалкил)фосфиновых кислот с различными углеводородными радикалами R и защитными группами на атоме азота Alk (Схема 1).
В то же время, синтез N,N`-алкилиденбискарбаматов и изучение их в реакции с различными гидрофосфорильными соединениями, а также выделение их в качестве стабильных интермедиатов трехкомпонентной карбаматной версии реакции Кабачника-Филдса позволили разработать универсальную методику построения аминофосфорильной функции с сохранением защитных групп на атоме азота [6-13]. Также ранее было показано, что при обработке реакционной массы в карбаматной версии Кабачника-Филдса спиртами, были получены моноэфиры N-защищенных а-аминофосфоновых кислот [8].

Схема 1. Схема «двойного» амидоалкилирования гипофосфористой кислоты
Таким образом, на второй стадии нашей работы была разработана методика двухкомпонентного «двойного» амидоалкилирования гидрофосфорильных соединений с участием N,N`-алкилиденбискарбаматов и гипофосфористой кислоты с последующей обработкой различными спиртами (Схема 2). Предложенная методика позволила осуществить амидоалкилирование гипофосфористой кислоты с получением P- и N‑защищенных бис(α-амино)фосфиновых кислот.
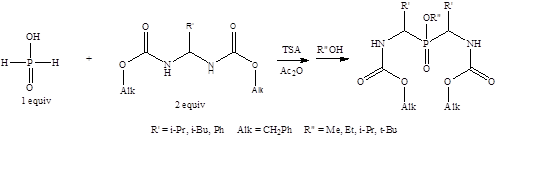
Схема 2. Получение P- и N-защещенных бис(а-амино)фосфиновых кислот
Кроме того, воспользовавшись стандартными методиками для снятия защитных групп с атомов азота и фосфора нами был получен ряд свободных бис(α-амино)фосфиновых кислот (Рисунок 2).

Рисунок 2. Свободные бис(α-амино)фосфиновые кислоты
Прогноз биологических активностей полученных N-CBz-защищенных, свободных бис(α-амино)фосфиновых кислот и непосредственно потенциальных фосфиновых аналогов ингибитора ВИЧ-1-протеазы (Таблица 1) осуществлялся программой PASS (“Prediction of Activity Spectra for Substances”), разработанная в Институте биомедицинской химии им. В.Н. Ореховича РАМН. Она содержит более 250000 веществ с известной биологической активностью, включает более 3500 фармакологических эффектов и механизмов действия. Результаты прогноза биологической активности представлены в виде спектра биологической активности, включающих список активностей и вероятностей: Ра − «быть активным», Рi − «быть неактивным.
В качестве контроля выступили бензил-замещенные молекулы (R = CH2Ph), которые были ранее синтезированы, испытаны и показали антивирусную активность. Было обнаружено, что в ряде фосфиновых аналогов ингибитора ВИЧ-1 протеазы у всех соединений присутствует вероятность проявить антивирусную активность, хотя эта вероятность чуть выше 50 %.
Таблица 1.
Прогноз биологических активностей полученных и планируемых соединений программой PASS
|
|
NH2 |
NHCBz |
NHValCBz |
|
Met |
0.407 |
0.426 |
0.547 |
|
Et |
0.356 |
0.391 |
0.507 |
|
sec-Pro |
0.472 |
0.420 |
0.547 |
|
sec-Bu |
0.473 |
0.424 |
0.543 |
|
iso-Bu |
0.362 |
0.393 |
0.511 |
|
Pn |
- |
0.179 |
0.519 |
|
Bn |
0.401 |
0.549 |
0.623 |
Также была использована программа GUSAR (“General Unrestricted Structure-Activity Relationships”), дающая прогноз по острой токсичности для крыс (LD50 мг/кг) соединений (http://www.way2drug.com/gusar/acutoxpredict.html). QSAR модели были разработаны для порядка 10000 соединений, протестированных на крысах по четырем видам токсичности – пероральной (ПО), внутривенной (ВВ), внутрибрюшинной (ВБ) и подкожной (ПК). Для оценки острой токсичности для описания структур химических соединений в программе используются дескрипторы многоуровневых атомных окрестностей (MNA – Multilevel Neighborhoods of Atoms) и количественных атомных окрестностей (QNA – Quantitative Neighborhoods of Atoms). В GUSAR для построения моделей используется алгоритм самосогласованной регрессии (SCR).
Так как все лекарства против ВИЧ принимаются перорально,
то в качестве критерия будут рассматриваться только пероральная и внутривенная острые токсичности.
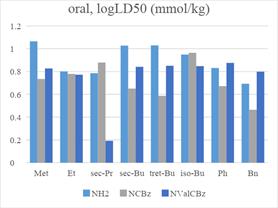
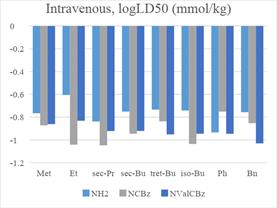
Растворимость оценивалась двумя способами:
- ALOGPS 2.1 [VCCLAB, Virtual Computational Chemistry Laboratory, http://www.vcclab.org]. В качестве метода использовалась нейронная сеть и 75 дескрипторов (E-state indicies, электротопологические индексы, характеризующие атомы и типы связей, предложенные Kier и Hall [14-16]. Для обучения были использованы 1291 молекулы. Статистические параметры модели представлены только среднеквадратичной ошибкой (RMSE=0.49).
- Согласованная модель (consensus model) растворимости неионизированного состояния (внутренняя), основанная на физико-химических дескрипторах и среднего арифметического трёх методов (Support Vector Machine, Random Forest и Local Regression Property) [17-18]. В качестве обучения были использованы 2615 соединений.
Для каждого из методов использовались следующие параметры: SVM (12 дескрипторов, 3-блоковая кросс-валидация с 20 итерациями (R2= 0.883, RMSE=0.78)), RF (12 дескрипторов, процедура out-of-bag и строилось 500 деревьев (R2= 0.839, RMSE=0.91)), LoReP (2 дескриптора (a (молекулярная поляризуемость) и AlogP (коэффициента распределения октанол/вода методом Ghose-Crippen) три пары соседей и кросс-валидация по отдельным элементам (R2= 0.858, RMSE=0.86). Общая статистические параметры для согласованной модели (R2=0.896, RMSE=0.86)
Результаты растворимости приведены на диаграммах.

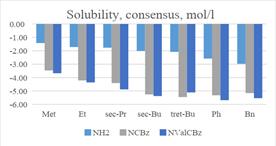
Таким образом, данные полученные в результате исследования фосфиновых аналогов ингибитора ВИЧ-1-протеазы согласуются с уже одобренными препаратами, ингибиторов ВИЧ-1 протеазы (Atazanavir, Darunavir, Indinavir, Ritonavir, Saquinavir, Fosamprenavir).


