СИНТЕЗ И ХИМИЧЕСКИЕ СВОЙСТВА АДАМАНТАНСОДЕРЖАЩИХ ЦИКЛОПРОПАНОВ С ЭЛЕКТРОНОАКЦЕПТОРНЫМИ ГРУППАМИ
Конференция: XLVI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Органическая химия

XLVI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
СИНТЕЗ И ХИМИЧЕСКИЕ СВОЙСТВА АДАМАНТАНСОДЕРЖАЩИХ ЦИКЛОПРОПАНОВ С ЭЛЕКТРОНОАКЦЕПТОРНЫМИ ГРУППАМИ
SYNTHESIS AND CHEMICAL PROPERTIES OF ADAMANTANE-CONTAINING CYCLOPROPANES WITH ELECTRON-WITHDRAWING GROUPS
Marat Baimuratov
Candidate of Chemical Sciences, assistant professor in Samara State Technical University, Russia, Samara
Marina Leonova
Candidate of Chemical Sciences, assistant professor in Samara State Technical University, Russia, Samara
Ul’yana Aristova
Graduate student in Samara State Technical University, Russia, Samara
Аннотация. Химия производных циклопропана является одной из интенсивно развивающихся областей органической химии. Однако, химические свойства циклопропанов адамантанового ряда малоизучены и можно полагать, что введение объемного каркасного фрагмента в структуру циклопропана будет влиять на химические свойства таких пространственно затрудненных субстратов. Разработаны методы получения адамантансодержащих циклопропанов с электроноакцепторными группами. Исследованы некоторые химические свойства полученных циклопропанов. Обнаружено, что адамантансодержащие циклопропаны и винилциклопропаны в кислой среде превращаются в соответствующие лактоны, в зависимости от строения исходного субстрата. Обнаружено, что реакция диэтилового эфира 2-(адамантан-1-ил)циклопропан-1,1-дикарбоновой кислоты с диазоуксусным эфиром в присутствии тетраацетата диродия приводит к смеси циклопропанов.
Abstract. The chemistry of cyclopropane derivatives is one of the rapidly developing areas of organic chemistry. However, the chemical properties of cyclopropanes of the adamantane series are poorly understood and it can be assumed that the introduction of a bulky fragment into the structure of cyclopropane will affect the chemical properties of such hindered substrates. We have developed methods for the preparation of adamantane-containing cyclopropanes with electron-withdrawing groups. Some chemical properties of the obtained cyclopropanes have been investigated. It was found that adamantane-containing cyclopropanes and vinylcyclopropanes in an acidic medium are converted into the corresponding lactones, depending on the structure of the initial substrate. It was found that the reaction of diethyl ester of 2- (adamantan-1-yl)cyclopropane-1,1-dicarboxylic acid with diazoacetic ester in the presence of dirodium tetraacetate leads to a mixture of tetrasubstituted cyclopropanes.
Ключевые слова: каркасные соединения; адамантан; циклопропаны; винилциклопропан; лактон; циклопропанирование; олефины.
Keywords: cage compounds; adamantane; cyclopropane; vinylcyclopropane; lactone; cyclopropanation; olefins.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект РФФИ 19-03-00929).
Химия производных циклопропана является одной из интенсивно развивающихся областей органической химии [3], [5], [6], [7]. Следует отметить, что химические свойства циклопропанов адамантанового ряда малоизучены. Поэтому можно полагать, что введение объемного каркасного фрагмента в структуру циклопропана будет влиять на химические свойства таких субстратов. Замещенные циклопропаны занимают одно из центральных мест в современной органической химии, поскольку эти соединения и их производные обладают ценными свойствами и находят широкое применение в различных областях науки. Природные и синтетические замещенные циклопропаны наделены широким спектром биологических свойств: от ингибирования ферментов до инсектицидных, антибактериальных, противоопухолевых и противовирусных свойств [2], [4].
Использование активированных циклопропанов в органическом синтезе значительно увеличилось за последние несколько лет за счет объединения современных каталитических методов с хорошо известной реакционной способностью этих строительных блоков. Все это позволило использовать их для синтеза сложных природных соединений [1].
Для получения адамантилсодержащего циклопропана 2 был предложен следующий путь синтеза.

На первой стадии путем прямого бромирования был получен дибромдиэтилмалоновый эфир (1) с выходом 94%. Далее полученный дибромид 1 вводили в реакцию циклопропанирования с олефинами адамантанового ряда.

В результате реакции дибромида 1 с 1-виниладамантаном получена смесь большого количества продуктов, содержание циклопропана 2 в которой составляет 11% (по данным ГХ-МС). Выделение циклопропана 2 из данной смеси не представляется возможным.
При замене меди на цинк-медную пару в аналогичных условиях реакция не идет.

Наилучшие результаты были получены по следующей схеме.
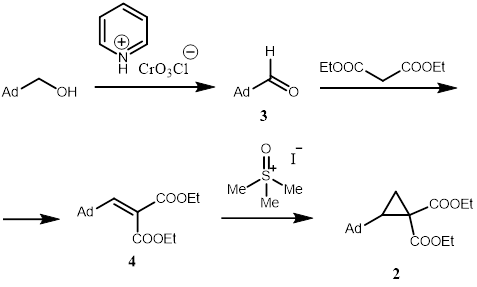
На первой стадии был получен альдегид 3 реакцией окисления из адамантилметанола. В качестве окислителя был синтезирован хлорхромат пиридиния. Далее полученный альдегид 3 вводили в реакцию конденсации по Кневенагелю с диэтилмалоновым эфиром в присутствии хлорида цинка и уксусного ангидрида с получением олефина 4 с выходом 88%. В условиях с пиперидином и уксусной кислотой в бензоле реакция не идет.

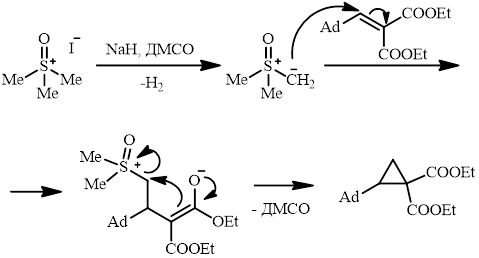
Полученное непредельное производное 4 под действием реагента Кори-Чайковского образует циклопропан 2 с выходом 87%.

Образование циклопропана 11 происходит по следующему механизму:
Нами была предпринята попытка получить циклопропан 5. Реакция олефина 4 с этилдиазоацетатом в присутствии Pd(OAc)2 не идет. А в результате реакции катализируемой Rh2(OAc)4 циклопропан 5 образуется с конверсией 27% (по данным ГХ-МС).

В результате реакции 1-[(Z)-1,4-дибромбут-2-ен-2-ил]адамантана 6 с диэтилмалонатом в присутствии гидрида натрия получен адамантансодержащий винилциклопропан 7 с умеренным выходом.

При добавлении исходного циклопропана 2 к концентрированной серной кислоте образуется смесь лактонов 8a, b и побочных продуктов. Аналогичные результаты были получены при проведении реакции в растворе дихлорметана. Наилучшие результаты были получены при проведении реакции в кипящем дихлорэтане с выходом лактона 8a, b 74%. По данным ЯМР спектроскопии смесь состоит из двух диастереомеров в соотношении 2:1 соответственно.

Механизм реакции:

Нами была проведена реакция в аналогичных условиях с диэтил-2-[1-(адамантан-1-ил)винил]циклопропан-1,1-дикарбоксилатом. Однако в спектре ЯМР не наблюдались характерные сигналы, соответствующие предполагаемому лактону. В ходе реакции был получен бициклический лактон 9.

Обнаружено, что реакция циклопропана 2 с этилдиазоацетатом в присутствии Rh2(OAc4) приводит к смеси тетразамещенных циклопропанов 10 и 11 в соотношении 6:1 (по данным ГХ-МС). При этом максимальная конверсия исходного циклопропана 2 достигала 26%.

Структуры данных соединений были предложены на основании масс-спектров, в которых имеются пики молекулярных ионов (m/z=406), для соединения 10 наблюдается пик (m/z=246), соответствующий отрыву диэтилмалонового фрагмента, а для соединения 11 пик адамантилкарбинильного иона (m/z=149). Вероятно, соединения 10 и 11 образуются в результате реакции соответствующих алкенов с этилдиазоацетатом.
Заключение. Таким образом, разработаны методы получения адамантансодержащих циклопропанов с электроноакцепторными группами. Исследованы некоторые химические свойства полученных циклопропанов. Обнаружено, что адамантансодержащие циклопропаны и винилциклопропаны в кислой среде превращаются в соответствующие лактоны, в зависимости от строения исходного субстрата. Обнаружено, что реакция диэтилового эфира 2-(адамантан-1-ил)циклопропан-1,1-дикарбоновой кислоты с диазоуксусным эфиром в присутствии тетраацетата диродия приводит к смеси циклопропанов.


