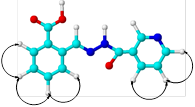
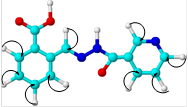
ПОЛУЧЕНИЕ КОМПЛЕКСОВ ВКЛЮЧЕНИЯ НОВЫХ ГИДРАЗОНОВЫХ ПРОИЗВОДНЫХ НИКОТИНОВОЙ КИСЛОТЫ С ЦИКЛОДЕКСТРИНАМИ
Конференция: LXXXII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Органическая химия

LXXXII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
ПОЛУЧЕНИЕ КОМПЛЕКСОВ ВКЛЮЧЕНИЯ НОВЫХ ГИДРАЗОНОВЫХ ПРОИЗВОДНЫХ НИКОТИНОВОЙ КИСЛОТЫ С ЦИКЛОДЕКСТРИНАМИ
Аннотация. В данной работе представлены результаты синтеза, теоретического и экспериментального исследования водорастворимых комплексов включения на основе ряда новых гидразонов никотиновой кислоты с циклодекстринами. Методами молекулярного моделирования и докинга выполнено in silico исследование комплексообразования между гидразонами никотиновой кислоты и a-, b-, g-циклодекстринами. На основании оцененной афинности связывания показано более эффективное связывание гидразонов с b-и g-циклодекстринами. Выпонен синтез новых гидразонов и их комплексов с b- и g-циклодекстринами в водно-спиртовой среде. Спектральные свойства комплексов включения охарактеризованы с помощью ИК-спектроскопии и 1H и 13C ЯМР-спектроскопии.
Ключевые слова: никотиновая кислота; гидразоны; циклодекстрины; супрамолекулярный комплекс; ЯМР спектроскопия.
Одним из перспективных субстратов в поиске новых биоактивных веществ являются производные 3-пиридинкарбоновой кислоты [1, с. 606]. На основе производных никотиновой кислоты разработано значительное количество лекарственных препаратов, применяемых в медицинской практике.
Привлекательность никотиногидразонов как биоактивных соединений обусловлена многогранностью их реакционной способности, а также практическим использованием производных бензилиденогидразонов в качестве «билдинг-блоков» в создании новых биоактивных средств и технических реагентов [2]. Однако многие производные гидразонов никотиновой кислоты характеризуются низкой растворимостью в водной среде, что не позволяет провести обширное изучение их биологических свойств.
В этой связи водорастворимые комплексы натуральных циклических природных макроциклов с биологически активными молекулами представляют собой один из наиболее интенсивно используемых объектов, что увеличивает растворимость органических молекул в составе комплексов, а также повышает их стабильность в среде физиологических жидкостей при хранении и т.д. [2, с. 272].
В качестве составляющего элемента супрамолекулярной системы для получения водорастворимых комплексов наиболее перспективно использование олигосахаридов циклического строения – α-, β- и γ-циклодекстринов (CD).
В литературе имеются лишь несколько данных, касающихся комплексообразования циклодекстринов с гостевыми структурами, сходными со структурой никотиновой кислоты. Результаты этих исследований показали, что в отличие от никотиновой кислоты, ее клатратные производные обладают более широким спектром биологической активности [5, с. 197].
В настоящей статье представлены результаты исследования по получению водорастворимых комплексов включений ряда новых гидразонов никотиновой кислоты с β-циклодекстрином и изучению их термохимических свойств.
Основными объектами научной работы послужили гидразид никотиновой кислоты, 2-карбок-сибензальдегид, фталальдегид, циннамальдегид и 2-хлор-6-фторальдегид (фирма Sigma-Aldrich) и их гидразоновые производные, а также a-, b- и g-циклодек-стрины (фирма 99.5 %, Fluka).
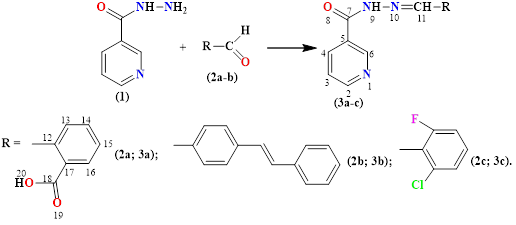
Новые гидразоны 2-((2-никотиноилгидразоно)метил)бензойной кислоты (3a), N'-(4-((E)-стирил)бензилиден)никотиногидразид (3b), N-(2-хлор-6-флуоро-бензилиден)никотиногидразид (3c) получены по следующей схеме.
Состав и строение соединений (3a-c) подтверждены данными ИК-, ЯМР 1Н- и 13С-спектроскопии, а также данными двумерных спектров COSY (1H-1H) и HMQC (1H-13C).
Спектр ЯМР 1Н соединения (3a) характеризуется присутствием ароматических протонов — фрагментов бензойной и никотиновой кислот при 7.46–7.51 м (2Н, Н-3, Н-13), 7.59 т (1Н, Н–15, 3J 7.4 Гц), 7.86–7.88 м (1Н, Н-14), 8.05 д (1Н, Н-16, 3J 7.6 Гц), 8.24 д (1Н, Н-4, 3J 7.6 Гц), 9.06 с (1Н, Н-6) и 9.18 с (1Н, Н-2) м.д. Ненасыщенный протон Н-11 проявился однопротонным синглетом при 8.70 м.д. Гидразиновый протон Н-9 резонировал однопротонным синглетом при 12.18 м.д. Из-за наличия обменных процессов у карбоксильного протона Н-20 с молекулами воды дейтерированного растворителя он проявился уширенным синглетом при 5.02 м.д.
В спектре ЯМР 13С соединения (3a) сигналы ароматических углеродных атомов фрагментов бензойной и никотиновой кислот проявились при 123.99 (С-3), 127.27 (С-16), 129.61 (С-5), 130.22 (С-13), 130.84 (С-14), 131.32 (С-17), 132.48 (С-15), 134.94 (С-12), 136.07 (С-4), 147.96 (С-2) и 149.17 (С-6) м.д. Непредельный углеродный атом С-11 регистрировался при 152.78 м.д. Карбонильные и карбоксильные углеродные атомы С-7 и С-18 резонировали при 162.51 и 168.58 м.д. соответственно.
В спектрах 1H-1H COSY соединения (3a) наблюдаются спин-спиновые корреляции через три связи протонов соседних метин-метинных ароматических групп Н13-Н15 (7.47, 7.60 и 7.60, 7.47), Н13-Н14 (7.47, 7.86 и 7.86, 7.47), 1515-Н16 (7.58, 8.04 и 8.04, 7.58), Н3-Н4 (7.48, 8.24 и 8.24, 7.48), Н13-Н11 (7.48, 8.70 и 8.70, 7.48) и Н6-Н2 (9.06, 9.16 и 9.16, 9.06) м.д. (рисунок 1).
|
а |
б |
Рисунок 1. Схема корреляций в спектрах COSY (а) и HMQC (б) соединения (3a)
Гетероядерные взаимодействия протонов с атомами углерода через одну связь были установлены с помощью спектроскопии 1H-13C HMQC для следующих присутствующих в соединениях пар: Н3-С3 (7.48, 124.02), Н13-С13 (7.46, 130.23), Н15-С15 (7.58, 132.51), Н16-С16 (8.04, 127.29), Н14-С14 (7.86, 130.88), Н4-С4 (8.22, 136.18), Н2-С2 (9.17, 148.08), Н11-С11 (8.69, 152.75) и Н6-С6 (9.05, 149.33) м.д.
Гетероядерные взаимодействия протонов с атомами углерода через две и более связей были установлены с помощью спектроскопии 1H-13C HMBC для следующих присутствующих в соединении пар: Н11-С3 (8.68, 123.92); Н2-С4 (9.18, 135.39), Н2-С2 (9.18, 147.92); Н20-С18 (12.16, 162.54) м.д.
2-((2-Никотиноилгидразоно)метил)бензойная кислота (3a). К смеси 2,74 г (0,02 М) гидразида никотиновой кислоты в 20 мл этанола добавляли при перемешивании 3 г (0,02 М) 2-карбоксибензальдегида в 30 мл этанола. Реакционную смесь перемешивали при температуре 60оС в течение 2 часов, а затем охлаждали до комнатной температуры. Сырой продукт отфильтровали, промывали и сушили. Перекристаллизация из изопропанола дала (3a) в виде белого порошка. Выход 97 %, т. пл. 220–222оС. ИК спектр (KBr), ν, см-1: 3414 (NH), 1697 (COамид), 1601 (C=N), 1601 (аром.). Масс-спектр, m/z, (Iотн,%): 270.125 (100) [M+H]+.
N'-(4-((E)-стирил)бензилиден)никотиногидразид (3b). Выход 79 %, желтый порошок, т. пл. 240–242оС. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д., (J, Гц): 7.24–7.36 (6Н, м, Н-19,21-25), 7.52–7.59 (4Н, м, Н-3,18,14,16), 7.66–7.72 (2H, м, H-13,17), 8.21–8.22 (1Н, м, Н-4), 8.39 (1Н, c, Н-11), 8.72–8.73 (1H, м, H-2), 9.03 (1H, с, H-6), 11.96 (1H, с, H-9). Спектр ЯМР 13С (ДМСО-d6), δС, м.д.: 124.02 (С-3), 127.19 (С-5), 127.45 (С-13,17,18,22-24), 128.14 (С-21,25), 129.29 (С-14,16), 130.05 (С-19), 133.85 (С-12), 135.92 (С-4), 137.06 (С-20), 139.16 (С-15), 148.52 (С-11), 149.09 (С-6), 152.72 (С-2), 162.08 (С-7). Спектр ЯМР COSY: Н-21,25→Н-22,24,23, Н-3→Н-4, Н-3→Н-2. Спектр ЯМР HMQC: Н-3→С-3, Н-21,25→С-21,25, Н-14,16→С-14,16, H-22-24→С-22-24, H-13,17→С-13,17, H-4→С-4, H-11→С-11, H-2→С-2, H-6→С-6. Спектр ЯМР HMВC: Н-6→С-5; Н-9→С-7.
N'-(2-хлоро-6-фторбензилиден)никотиногидразид (3c). Выход 84 %, белый порошок, т. пл. 198–199оС. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д., (J, Гц): 7.22-7.31 (1Н, м, Н-15), 7.36–7.37 (1Н, м, Н-16), 7.41–7.42 (1H, м, H-14), 7.51–7.54 (1Н, м, Н-3), 8.22–8.24 (1Н, м, Н-4), 8.65 (1H, с, H-11), 8.73 (1H, с, H-2), 9.04 (1H, с, H-6), 12.21 (1Н, с, Н-9). Спектр ЯМР 13С (ДМСО-d6), δС, м.д.: 116.06 и 116.28 (С-16), 120.89 и 121.02 (С-12), 124.13 (С-3), 126.59 (С-14), 129.38 (С-13), 132.37 (С-15), 134.47 (С-5), 136.07 (С-4), 142.36 (С-11), 149.19 (С-6), 152.98 (С-2), 159.41 и 161.98 (С-17), 162.28 (С-7). Спектр ЯМР COSY: Н-15→Н-14, Н-3→Н-4, Н-3→Н-2. Спектр ЯМР HMQC: Н-3→С-3, Н-16→С-16, Н-14→С-14, H-15→С-15, H-4→С-4, H-4→С-4, H-11→С-11, H-2→С-2, H-6→С-6. Спектр ЯМР HMВC: Н-11→С-12, С-5; Н-9→С-7, С-11.
В супрамолекулярной химии определяющую роль играют размеры и форма или геометрическая комплементарность взаимодействующих компонентов [4, с. 105]. С целью выбора наиболее эффективного комплексообразующего агента из a, b- и g-циклодекстринов для субстратов (3а)-(3с) был выполнен молекулярный докинг — исследование комплексов «хозяин–гость» для системы «циклодекстрин-гидразон» (1:1) с оценкой афинности связывания (рисунок 2).
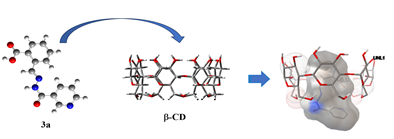
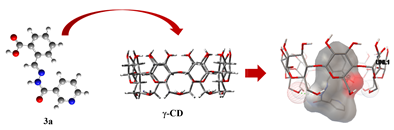
Рисунок 3. Схематическое представление комплексообразования гидразона никотиновой кислоты (3а) с β- и γ-циклодекстринами
В рамках подготовки молекулярных структур объектов исследования к докингу их геометрия была первоначально оптимизирована методом DFT RB3LYP/6-31G CPCM (water) для определения наиболее устойчивых конформаций и оценки их параметров [3, с. 2211].
Соотношение геометрических параметров молекул гидразонов в качестве «гостей» с размерами полостей молекул a-, b- и g-циклодекстринов позволяет предположить наиболее эффективное связывание с b- и g-циклодекстринами, так как «контейнер» молекулы a-циклодекстрина слишком мал для вмещения молекул исследуемых гидразонов.
Методика получения комплекса включения 2-((2-никотиноилгидразоно) метил)бензойной кислоты с β-CD (4a). К концентрированному раствору 2-((2-никотиноилгидразоно)метил)бензойной кислоты (0,0006 М) в 7 мл ДМФА в соотношении 1:1 по каплям вносят насыщенный раствор β-CD (0,0006 моль) в 15 мл воды, перемешивают при температуре 50–60°С 3–4 часа. Выпавший при охлаждении (4оС) осадок отфильтровывают через воронку Шотта. Конечный продукт был высушен при комнатной температуре (22–23°С). Комплекс включения гидразона с β-циклодекстрином был получен в виде водорастворимого белого порошка. Общий выход продукта составил 22 %, т. пл. 230°С.
Комплекс включения N'-(4-((E)-стирил)бензилиден)никотиногидразид с β –CD (4b) получен аналогично (4а) в виде водорастворимого желтого порошка. Общий выход продукта составил 19 %, т.пл. 243–245оС.
Комплекс включения N-(2-хлор-6-флуоробензилиден)никотиногидразида с β-CD (4c) получен аналогично (4а) в виде водорастворимого белого порошка. Общий выход продукта составил 16 %, т.пл. 305оС.
Комплекс включения N-(2-хлор-6-флуоробензилиден) никотиногидразида с γ -CD (4d) получен аналогично (4а) в виде водорастворимого белого порошка. Общий выход продукта составил 17 %, т.пл. 265–270оС. Спектры ЯМР 1Н и 13С комплексов 4а–4d приведены в таблице 1.
Таблица 1.
Спектры ЯМР 1Н и 13С комплексов 4а–4d
|
№ Соед. |
Группа |
δ0, м.д. |
δ, м.д. |
∆δ = δ - δ0 |
||||
|
1Н |
13С |
1Н |
13С |
1Н |
13С |
|||
|
β-Циклодекстрин |
||||||||
|
4а |
H3 |
3.60 м |
73.64 |
3.58 |
73.37 |
-0.02 |
-0.28 |
|
|
H5 |
3.49 м |
72.50 |
3.50 |
73.21 |
0.01 |
-0.29 |
||
|
4b |
H3 |
3.60 м |
73.64 |
3.58 |
73.37 |
-0.02 |
-0.28 |
|
|
H5 |
3.49 м |
72.50 |
3.50 |
73.21 |
0.01 |
-0.29 |
||
|
4c |
H3 |
3.60 м |
73.64 |
3.61 |
73.55 |
0.01 |
-0.09 |
|
|
H5 |
3.49 м |
72.50 |
3.49 |
72.51 |
0 |
-0.01 |
||
|
4d |
H3 |
3.37 м |
73.44 |
3.62 |
73.07 |
0.25 |
-0.37 |
|
|
H5 |
3.37 м |
73.11 |
3.44 |
72.27 |
0.07 |
-0.84 |
||
Заключение
В ходе работы получены водорастворимые комплексы включений ряда новых гидразонов никотиновой кислоты с циклодекстринами (β-ЦД, γ-ЦД) в водно-спиртовой среде. Методами молекулярного докинга и моделирования выполнено in silico исследование комплексообразования гидразонов никотиновой кислоты с циклодекстринами. Анализ полученных данных показал, что с a-циклодекстрином гидразоны имеют поверхностное связывание, без проникновения молекулы гостя в полость хозяина, что проявляется в низких значениях афинности связывания. Во всех остальных случаях гидразоны демонстрируют частичное или полное проникновение внутрь полости циклодекстринов. В случае с g-циклодекстрином, несмотря на проникновение молекул «гостей» внутрь полости тора, исследуемые гидразоны демонстрируют менее эффективное связывание, чем в случае с b-циклодекстрином, что обусловлено несоответствием размера полости тора g-циклодекстрина геометрическим параметрам молекул гидразонов. Высокие значения энергии активации комплексов включений новых гидразонов никотиновой кислоты указывают на стабильность и прочность сформированных связей в изученных клатратах.