Разработка тест-системы на основе молекулярно-биологических методов в целях совершенствования лабораторной диагностики гонореи
Конференция: VIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Клиническая лабораторная диагностика

VIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Разработка тест-системы на основе молекулярно-биологических методов в целях совершенствования лабораторной диагностики гонореи
Development of a PCR test system based on molecular methods for improved laboratory diagnosis of gonorrhoea
Natalia Lysenko
graduate student Saint-Petersburg State Technological Institute (Technical University), Russia, St. Petersburg
Olga Freylikhman
PhD, St. Petersburg Pasteur Institute, Russia, St. Petersburg
Anastasia Vaganova
junior researcher, St. Petersburg Pasteur Institute, Russia, St. Petersburg
Natalia Miroshnikova
PhD, Head of the Department of Biological and Technical Control, St. Petersburg Pasteur Institute, Russia, St. Petersburg
Nikolai Mikhailov
PhD, St. Petersburg Pasteur Institute, Russia, St. Petersburg
Vyacheslav Verbov
PhD, Head of the Department of New Technologies, St. Petersburg Pasteur Institute, Russia, St. Petersburg
Аннотация. Представлены результаты разработки тест-системы на основе ПЦР в режиме реального времени для детекции Neisseria gonorrhoeae – возбудителя гонореи. В качестве генетической мишени выбран фрагмент гена «домашнего хозяйства» pgm, кодирующего синтез фермента фосфоглюкомутазы. С помощью биоинформатических методов и баз данных сконструированы высокоспецифичные праймеры и зонды. Осуществлено мультиплексирование созданной тест-системы с системой для амплификации фрагментов генома человека, используемой в качестве внутреннего положительного контроля. Произведена оценка показателей эффективности разработанной тест-системы: аналитическая чувствительность составила менее 10 ГЭ/мл, эффективность реакции – 103,2 %.
Abstract. This study describes development of a real-time PCR system for specific detection of Neisseria gonorrhoeae, the causative agent of gonorrhea. A region on the housekeeping gene pgm encoding phosphoglucomutase was used as a target. By the use of the bioinformatics methods and databases primers and probes against the N. gonorrhoeae pgm gene were designed. The real-time PCR system was successfully combined with an internal amplification control of a human DNA. In conclusion, important parameters of quantitative PCR were analyzed: analytical sensitivity of the real-time PCR system is less than 10 genome equivalents and the reaction efficiency is 103.2 %.
Ключевые слова: Neisseria gonorrhoeae; гонорея; гонококк; ПЦР в режиме реального времени; ген «домашнего хозяйства»; pgm
Keywords: Neisseria gonorrhoeae; gonorrhea; gonococcus; real-time PCR; housekeeping gene; pgm
Введение. Согласно данным Всемирной организации здравоохранения, в мире ежегодно регистрируется свыше 78 миллионов случаев заболевания гонореей [1]. Эта инфекция относится к заболеваниям, передающимся половым путем. Возбудителем гонореи является грамотрицательный диплококк Neisseria gonorrhoeae (гонококк). В значительной части случаев инфицирования заболевание протекает бессимптомно, что придает первостепенное значение своевременной лабораторной диагностике.
Бактериологический метод выделения возбудителя является трудоемким, а также довольно времязатратным, так как получение окончательного результата занимает до нескольких дней. Бактериоскопический метод диагностики не обладает достаточной чувствительностью и специфичностью, особенно при хронических формах заболевания. Поэтому наиболее перспективным путем совершенствования методов лабораторной диагностики гонореи является использование молекулярно-биологических методов, а именно: разработка тест-систем на основе ПЦР в режиме реального времени (ПЦР-РВ), способных обеспечить высокую чувствительность (геномных эквивалентов (ГЭ) на 1 мл), специфичность и оперативность исследования [2].
Поиск высокоспецифичных ДНК-мишеней при анализе генома N. gonorrhoeae является трудновыполнимой и трудоемкой задачей, что обусловлено гомологией генома N. gonorrhoeae с геномами близкородственных видов рода Neisseria (Neisseria meningitidis и ряд видов непатогенных нейссерий), а также c высокой вариабельностью генома, ввиду выраженной способности N. gonorrhoeae к обмену участками генома с микроорганизмами рода Neisseria и гетерологичными видами [3].
Цель работы. Целью работы является разработка диагностической тест-системы, предназначенной для детекции ДНК N. gonorrhoeae методом ПЦР в режиме реального времени, а также оценка показателей ее эффективности для диагностики гонореи.
Материалы и методы. На основе анализа генома N. gonorrhoeae с помощью биоинформационной базы данных NCBI (https://www.ncbi.nlm.nih.gov/) была выявлена высокоспецифичная ДНК-мишень – ген «домашнего хозяйства» pgm, кодирующий синтез фермента фосфоглюкомутазы [4]. Гены «домашнего хозяйства», или конститутивные гены, необходимы для поддержания важнейших жизненных функций клетки, они обладают высокой внутривидовой консервативностью, а также экспрессируются на постоянном уровне, что обуславливает перспективность их использования в качестве ДНК-мишеней для детекции N. gonorrhoeae.
Поиск нуклеотидной последовательности гена pgm осуществлялся с помощью базы данных GenBank (https://www.ncbi.nlm.nih.gov/genbank/). Для конструирования высокоспецифичных праймеров и зондов было проведено множественное выравнивание гомологичных последовательностей близкородственных видов рода Neisseria в программе AlignX Vector NTI 11.0 (Invitrogen, США), а также в программе BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi).
Материалом для исследований служили образцы ДНК, выделенные из последовательных десятикратных разведений бактериальной суспензии типового штамма N. gonorrhoeae NCTC 8375/ ATCC 19424, а также из изолята N. gonorrhoeae с концентрацией 108 КОЕ/мл с помощью набора реагентов «QIAamp DNA Mini Kit (50)» («Qiagen», Германия) согласно инструкции производителя.
ПЦР-РВ осуществлялась в амплификаторе CFX96 Touch Real-Time («Bio-Rad Laboratories», США) при следующем температурном режиме: 95 °С – 5 мин (начальная денатурация), 1 цикл; 95 °С – 15 с (денатурация), 60 °С – 30 с (отжиг), 70 °С – 30 с (элонгация), 50 циклов. Смесь для амплификации N. gonorrhoeae включала в свой состав qPCRmix-HS («Евроген», Россия), синтезированные олигонуклеотидные праймеры и зонд («Beagle biotechnology», Россия), раствор MgCl2 («Kapa Biosystems», ЮАР), деионизированную воду (ddH2O), а также образец ДНК. Конечный объем смеси составлял 25 мкл. Детекцию уровней флуоресценции проводили в конце стадии отжига праймеров по каналам HEX и FAM.
Для построения стандартной кинетической кривой использовались образцы ДНК, выделенные из последовательных десятикратных разведений бактериальной суспензии N. gonorrhoeae, в диапазоне концентраций 107 – менее 10 ГЭ/мл (разведения от 10-1 до 10-7). Каждый образец ДНК был амплифицирован в дупликатах (технических повторах) параллельно с отрицательным контролем реакции (ОКР), в котором ДНК стандартного образца заменена водой.
В качестве внутреннего положительного контроля (ВПК) реакции использовалась система, предназначенная для амплификации консервативных мишеней генома человека. Для предварительного тестирования разработанной тест-системы были приготовлены модельные образцы, содержащие ДНК N. gonorrhoeae и геномную ДНК культуры клеток человека линии L-68 здоровой ткани легкого (ООО «СибЭнзим», Россия) в известной концентрации. В качестве специфичных ДНК-мишеней были выбраны высококонсервативные последовательности β-актина млекопитающих, ERV-3 (эндогеннного ретровируса-3 человека), а также GAPDH (глицеральдегид-3-фосфат-дегидрогеназы). Амплификация проводилась параллельно с ОКР реакции, в качестве которых использовалась ДНК культуры клеток человека и вода.
Специфичность разработанной тест-системы оценивалась с использованием ДНК гетерологичных видов микроорганизмов, таких как Escherichia coli, Klebsiella oxytoca, K. pneumonia, Trichomonas vaginalis, Micoplasma hominis, Ureaplasma urealiticum, U. parvum, Leptospira interrogans, а также Coxiella burnetii.
Результаты. Учет результатов ПЦР-РВ проводили, анализируя стандартную кривую, а также кривые накопления флуоресцентного сигнала, полученные с помощью программы Bio-Rad CFX Manager 3.1 («Bio-Rad Laboratories», США).
1) Анализ кривых накопления флуоресцентного сигнала
Анализ кинетических кривых (рис.1) позволил выявить особенности амплификации ДНК фрагмента гена pgm N. gonorrhoeae.

Рисунок 1. Кинетические кривые, полученные в результате амплификации ДНК фрагмента гена pgm N. gonorrhoeae в концентрациях от 107 до <10 ГЭ/мл
Интенсивность флуоресценции напрямую отражала количество специфического продукта: образцам с высоким содержанием ДНК N. gonorrhoeae соответствовало низкое значение пороговых циклов амплификации (Ct = 17), в то время как образцам c низкой концентрацией ДНК – высокое значение (Ct = 40). В диапазоне концентраций 105 – 10 ГЭ/мл в экспоненциальной фазе кривые плавления были параллельны друг другу, а также имели сигмовидную форму с тенденцией выхода на плато, что характеризует стандартный график накопления ДНК [5].
За аналитическую чувствительность тест-системы было принято минимальное детектируемое количество ДНК в образце. Аналитическая чувствительность разработанной тест-системы составила менее 10 ГЭ/мл ДНК N. gonorrhoeae (рис.1).
2) Анализ стандартной кривой
Определение абсолютной концентрации геномных эквивалентов (ГЭ) N. gonorrhoeae в клиническом материале проводилось сопоставлением кинетики реакции в исследуемых и стандартных образцах. Для количественной оценки абсолютной концентрации, а также эффективности реакции была построена стандартная кривая (рис.2). Критериями оценки эффективности амплификации служили значение среднего уровня корреляции, среднее значение наклона стандартной кривой, а также процентный показатель эффективности реакции, вычисленные программой амплификатора автоматически.
Средний уровень корреляции (R2) отражает линейность полученной стандартной кривой. Приемлемыми считаются значения R2 в диапазоне 0,98-1 [6]. В результате амплификации фрагмента гена pgm показатель R2 составил 0,999. Полученный результат свидетельствует о достоверности результатов, а также о корреляции между абсолютной концентрацией ДНК N. gonorrhoeae и значением пороговых циклов амплификации (Ct).
Учитывая, что среднее значение наклона стандартной кривой (Slope) является мерой эффективности реакции, для получения точных и воспроизводимых результатов процентный показатель эффективности реакции (Е) должен достигать 90 % - 110 %, что соответствует диапазону значений наклона стандартной кривой от -3, 58 до -3,10 [6]. Эффективность разработанной тест-системы составила 103, 2 %, что соответствует значению наклона стандартной кривой -3, 247. Высокая эффективность свидетельствует о специфичной гибридизации праймеров и зондов с ДНК-мишенью – фрагментом гена pgm, а также об оптимально подобранных концентрациях амплификационной смеси.
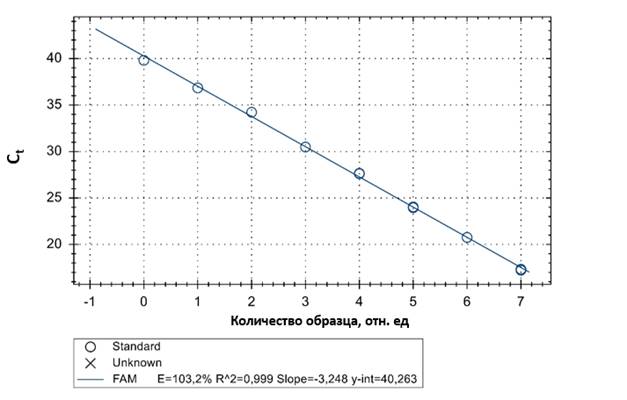
Рисунок 2. Стандартная кривая E – процентный показатель эффективности реакции; R2 – коэффициент корреляции; Slope - наклон стандартной кривой
3) Мультиплексирование с внутренним положительным контролем
В ходе мультиплексирования созданной тест-системы с системой для амплификации фрагментов генома человека, в качестве специфичных ДНК-мишеней было протестировано несколько высококонсервативных последовательностей. В случае использования в качестве мишени последовательности ERV-3 (эндогеннного ретровируса-3 человека), формы кинетических кривых практически не отклоняются от сигмовидных, что обуславливает ее выбор в качестве ДНК-мишени для внутреннего положительного контроля.
4) Оценка специфичности разработанной тест-системы
Специфичность разработанной тест-системы оценивалась с использованием ДНК гетерологичных видов микроорганизмов. В ходе реакции неспецифичных взаимодействий не выявлено, что свидетельствует о внутривидовой консервативности выбранной ДНК-мишени – гене «домашнего хозяйства» pgm, а также о высокой специфичности подобранных олигонуклеотидных праймеров и зонда.
Выводы:
1) Создана оригинальная диагностическая тест-система, предназначенная для детекции ДНК N. gonorrhoeae, включающая комплект олигонуклеотидных праймеров и зондов, позволяющих эффективно и специфично амплифицировать ДНК-мишень – фрагмент гена pgm.
2) Произведена оценка показателей эффективности разработанной тест-системы: аналитическая чувствительность составила менее 10 ГЭ/мл, эффективность реакции - 103, 2 %.
3) Осуществлено мультиплексирование созданной тест-системы для обнаружения N. gonorrhoeae с системой для амплификации фрагментов генома человека, используемой в качестве внутреннего положительного контроля.
4) Произведена оценка специфичности разработанной тест-системы с использованием ДНК гетерологичных видов микроорганизмов, кросс-реакций не выявлено.
Заключение. Разработанная диагностическая тест-система, предназначенная для детекции N. gonorrhoeae, показала высокую эффективность, аналитическую чувствительность и специфичность, что обосновывает возможность ее применения в лабораторной диагностике гонореи.


