Критерий приемлемости минимально допустимого числа таблеток для расчета результатов количественного определения
Конференция: IX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Организация фармацевтического дела

IX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Критерий приемлемости минимально допустимого числа таблеток для расчета результатов количественного определения
THE ACCEPTANCE CRITERION FOR THE MINIMUM ACCEPTABLE NUMBER OF TABLETS FOR CALCULATION OF ASSAY RESULTS
Dmytro Leontiev
Doctor of Pharmaceutical Sciences, Deputy Director of Science, Ukrainian Scientific Pharmacopoeial Centre for Quality of Medicines, Ukraine, Kharkiv
Oleksandr Gryzodub
Doctor of Chemical Sciences, Chief Scientific Officer, Ukrainian Scientific Pharmacopoeial Centre for Quality of Medicines, Ukraine, Kharkiv
Natalia Volovyk
Candidate of Pharmaceutical Sciences, Deputy Head of the Department of Validation and Reference Standards, Ukrainian Scientific Pharmacopoeial Centre for Quality of Medicines, Ukraine, Kharkiv
Vasyl Petrus
PhD Student, National University of Pharmacy, Ukraine, Kharkiv
Аннотация. Приготовление однородной пробы для количественного определения в дозированных лекарственных средствах может быть проблематичным, в то же время использование неоднородной пробы создает риск искажения результатов. В статье предлагается критерий для оценки корректности расчета результата количественного определения из результатов однородности дозированных единиц для минимально допустимого числа единиц твердых лекарственных средств, позволяющий минимизировать риск получения некорректных результатов.
Abstract. The preparation of a homogeneous sample for the assay in dosage forms might be problematic, while the use of an inhomogeneous sample creates the risk of results distortion. The article offers a criterion to assess the correctness of the calculation of assay result from the results of uniformity of dosage units for the minimum acceptable number of units of solid dosage forms, which allows minimising the risk of obtaining incorrect results.
Ключевые слова: Количественное определение; стратегия усреднения; твердые дозированные лекарственные средства; однородность дозированных единиц; критерий приемлемости; минимально допустимое число единиц; генеральное RSD для серии.
Keywords: Assay; averaging strategy; solid dosage forms; uniformity of dosage units; acceptance criterion; minimum acceptable number of units; RSD for population.
Количественное определение (КО) является одним из ключевых показателей качества лекарственных средств. В Европейском сообществе для готовых лекарственных средств допуски содержания ± 5 % являются общепринятым стандартом качества [9]. Для дозированных лекарственных средств, наиболее распространенными из которых являются твердые дозированные лекарственные средства (ТДЛС), в силу сильного влияния технологического варьирования допускается разброс между единицами ТДЛС, который существенно превышает допуски содержания для КО [7]. Поэтому для КО ТДЛС необходимо использовать соответствующую стратегию усреднения [3, 6]. Общепринятой стратегией усреднения для ТДЛС является использование однородной таблеточной массы из 20 индивидуальных единиц.
При измельчении таблеток, покрытых оболочкой, имеется высокий риск получения неоднородной таблеточной массы, и, в связи с этим, риск искажения результата КО. КО ТДЛС может быть рассчитано из результатов теста «Однородность дозированных единиц» (ОДЕ). Однако применение теста ОДЕ для расчета КО имеет ряд недостатков. Во-первых, выполнение теста ОДЕ может ограничиваться использованием 10 таблеток, что не соответствует стратегии усреднения для КО. Кроме того, проведение теста ОДЕ в некоторых случаях является необязательным (например, в процессе фармацевтической разработки при изучении стабильности ТДЛС). Специально проводить тест ОДЕ с использованием 20 таблеток для последующего использования результатов для расчета результатов КО является достаточно затратным.
В связи с вышесказанным, актуальным является установление минимально допустимого количества таблеток для оценки соответствия ТДЛС спецификациям по тесту КО, исходя из результатов анализа индивидуальных единиц ТДЛС. Однако критерии приемлемости минимального числа таблеток для расчета результатов КО ранее сформулированы не были.
Поэтому цель данной работы заключалась в обосновании критерия метрологической корректности расчета результата КО из результатов анализа минимального числа единиц ТДЛС.
Можно видеть, что в современной редакции теста ОДЕ, гармонизированного между Европейской Фармакопеей, Фармакопеей США и Фармакопеей Японии [7], приемочное число AV (Acceptance Value) = 15 % представляет собой доверительный интервал, в пределах которого с надежностью 95 % находятся результаты содержания действующего вещества в индивидуальных единицах ТДЛС. Следовательно, допустимое варьирование результатов КО, обусловленное использованием выборки из 20 единиц ТДЛС, можно оценить из требований к ОДЕ (1) [2]:
|
maxΔSampling = 15/√20 = 3.35 %, |
(1) |
где: maxΔSampling – максимально допустимое варьирование результатов КО, обусловленное неоднородностью пробы, выраженное как односторонний доверительный интервал, в процентах, для уровня надежности 95 %;
15 – максимально допустимый интервал отклонений содержания действующего вещества от номинального значения, в процентах, для индивидуального ТДЛС;
20 – число единиц ТДЛС, используемых для получения усредненной пробы для КО.
Для конкретного ТДЛС в условиях валидированного окружения может быть установлено генеральное значение RSD для варьирования действующего вещества между единицами ТДЛС. Отметим, что такая оценка является специфичной именно для конкретного ТДЛС, полученного по конкретной технологии. RSD не должно превышать 10 %, что контролируется тестом ОДЕ [8]. Чем меньше фактическое значение RSD, тем меньшее число таблеток метрологически корректно использовать для расчета результатов КО. Зная значение генерального RSD для конкретного ТДЛС, возможно оценить варьирование, обусловленное неоднородностью пробы, полученной из выборки для n единиц ТДЛС:
|
factΔSampling = RSD/√n∗t, |
(2) |
где: factΔSampling – односторонний доверительный интервал для уровня надежности 95 %, обусловленный варьированием между единицами конкретного ТДЛС;
n – число единиц ТДЛС, для которых были получены результаты определения индивидуального содержания и рассчитан результат КО как среднее значение;
t – односторонний коэффициент Стьюдента для уровня надежности 95 %.
В случае (2) корректно использовать односторонний коэффициент Стьюдента t, поскольку найденное значение содержания, усредненное по n таблеткам, может выходить за пределы спецификаций либо в большую, либо в меньшую сторону, но не в обе стороны одновременно. Использование для данного случая двустороннего коэффициента Стьюдента эквивалентно уровню надежности 97.5 %, а не 95 % [4].
При выполнении КО factΔSampling (2) не должно превышать maxΔSampling, т. е. 3.35 % в соответствии с (1). Исходя из этого возможно оценить требования к генеральному значению RSD, исходя из минимального числа единиц ТДЛС (Табл. 1), из результатов анализа которых можно корректно рассчитывать результат КО.
Таблица 1.
Результаты оценки метрологически корректного минимального числа единиц ТДЛС для расчета результатов КО
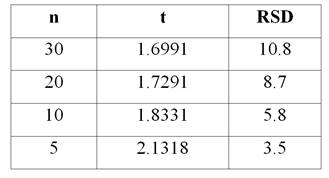
В соответствии с отчетом [8], для современного уровня технологии значение RSD = 3÷5 % считается хорошим, а значение RSD = 1.5 % следует считать предельно достижимым (т. е. оно может быть реализовано только для «идеальных» ТДЛС и для «идеального» оборудования). Отметим, что данная оценка была сделана для однородности таблеточной массы, т. е. на указанные значения RSD для ТДЛС накладывается еще и варьирование в массе единиц ТДЛС [1]. Если имеются какие‑либо объективные сложности с обеспечением однородности (например, низкое содержание действующего вещества по отношению к массе единицы ТДЛС), то значение RSD может быть существенно выше, вплоть до предельно допустимого RSD = 10 %.
Можно видеть, что на уровне надежности 95 % для расчета корректного значения КО анализ 10 индивидуальных единиц ТДЛС может быть приемлемым для всех беспроблемных ТДЛС. Для некоторых ТДЛС может быть достаточным анализ только 5 единиц ТДЛС.
Уменьшение числа единиц до менее 5 представляется некорректным, т. к. столь маленькая выборка перестает отражать свойства генеральной совокупности [5]. Анализ 30 единиц ТДЛС приемлем всегда, т. к. генеральное RSD всегда должно быть не более 10 %. Однако для ТДЛС, для которых имеются проблемы с обеспечением идеальной однородности для единиц ТДЛС, первой стадии ОДЕ может быть недостаточно для расчета корректного значения КО.
Таким образом, можно сделать вывод, что для обеспечения надежности результата КО, полученного усреднением результатов анализа менее чем 30 индивидуальных единиц ТДЛС, требуется экспериментальное подтверждение корректности результата.
Необходимо отметить специфику практического применения данного подхода. Аналитическая методика, которая должна содержать стратегию усреднения, разрабатывается перед проведением фармацевтической разработки и является элементом ее обеспечения. На этапе разработки методики отсутствует промышленная серия ТДЛС, значение RSD для которой необходимо знать, чтобы корректно разработать стратегию усреднения для аналитической методики.
Таким образом, для корректного применения предложенного критерия необходимо разработать подход к оценке прогнозируемого максимального значения RSD для конкретного ТДЛС, которое будет обеспечено для промышленного выпуска.
Другая проблема связана с гарантией качества для рутинно выпускаемого ТДЛС. Несмотря на то, что все процессы должны быть валидированы, GMP предполагает постоянный контроль за отсутствием непредвиденных изменений, обеспеченный экспериментальным доказательством. В данном случае стратегия усреднения аналитической методики базируется на предположении о том, что реальное значение RSD при выпуске промышленных серий не превышает прогнозируемого значения.
Следовательно, для обеспечения корректности результата КО, полученного путем расчета из результатов индивидуального содержания для менее, чем 30 единиц, необходимо в процессе рутинного контроля качества получать подтверждение, что требования к минимально допустимому RSD для конкретной контролируемой серии продолжают выполняться.
Выводы:
1. Предложен критерий оценки минимально допустимого числа единиц твердых дозированных лекарственных средств, из результатов анализа которых может быть рассчитан результат количественного определения. Показано, что использование менее 30 единиц твердых дозированных лекарственных средств требует экспериментального обоснования.
2. Сформулированы условия практического применения предложенного подхода: необходимость прогноза RSD для промышленных серий на этапе разработки методики и экспериментального подтверждения того, что в ходе рутинного контроля качества генеральное RSD для выпускаемых серий не превышает критическое значение.


