Нейронспецифическая енолаза, как перспективный маркер для ранней диагностики периферической полинейропатии, возникающей при сахарном диабете 1 и 2 типа
Конференция: X Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Молекулярная биология

X Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Нейронспецифическая енолаза, как перспективный маркер для ранней диагностики периферической полинейропатии, возникающей при сахарном диабете 1 и 2 типа
Исследование было выполнено при поддержке гранта от Фонда содействия развитию малых форм предприятий в научно-технической сфере: УМНИК № 0018719.
Аннотация. Целью настоящего исследования являлось изучение динамики концентрации нейронспецифической енолазы в крови при прогрессирующем развитии диабетической нейропатии у крыс с модельным сахарным диабетом 1 и 2 типа. Результаты нашего исследования демонстрируют, что уровень нейронспецифической енолазы в крови животных с модельным сахарным диабетом повышается, коррелирует с развитием нейропатии и может отражать ранние гистологические изменения в периферических нервах. При этом содержание гамма-енолазы не различается статистически при сравнении разных типов диабета, что предоставляет возможность в перспективе использовать гамма-енолазу в качестве биомаркера для ранней диагностики полинейропатии, как при сахарном диабете 1 типа, так и при сахарном диабете 2 типа.
Ключевые слова: нейронспецифическая енолаза; сахарный диабет; диабетическая полинейропатия.
Введение. Сахарный диабет – группа метаболических заболеваний, характеризующаяся стойким повышением содержания глюкозы в крови, которое возникает в результате недостаточности выработки инсулина поджелудочной железой (сахарный диабет 1 типа) или вследствие нарушения чувствительности тканей к инсулину (сахарный диабет 2 типа). По данным ВОЗ за 2016 год, во всем мире 422 млн. человек страдают от сахарного диабета. При этом согласно статистике ВОЗ, заболеваемость сахарным диабетом в мире растет, а по прогнозам, к 2030 году диабет будет занимать 7 место среди причин смертности.
Одной из наиболее часто развивающихся форм осложнений сахарного диабета наряду с нефро- и ретинопатией является диабетическая полинейропатия, которая нередко приводит к инвалидизации пациентов и летальному исходу. Диабетическая нейропатия представляет собой комплекс патологических изменений в периферических нервах, вегетативной и центральной нервной системе, в результате которых происходит нарушение функционирования нервных волокон и возникает соответствующая неврологическая симптоматика. Частота возникновения полинейропатии при сахарном диабете 1 типа по разным данным составляет от 54 до 59 %, а при сахарном диабете 2 типа – около 45 % [10].
На сегодняшний день для диагностики диабетической полинейропатии применяют различные тесты, среди которых можно выделить группу тестов по оценке чувствительности, исследование скорости проведения импульсов по нервным волокнам и динамометрию. Стоит также отметить, что существующие технологии применяются для диагностики нейропатии при манифестации клинической симптоматики и не всегда позволяют выявить патологию на ранней доклинической стадии.
Большой интерес вызывает поиск маркеров для диагностики нейропатии на раннем доклиническом этапе. Среди кандидатов одним из перспективных маркеров является тканеспецифический фермент – нейронспецифическая енолаза (гамма-енолаза, НСЕ). Этот фермент в норме локализован в цитоплазме нейронов и нейроэндокринных клеток и катализирует превращение 2-фосфо-D-глицериновой кислоты в фосфоенолпируват в ходе гликолиза. Известно также, что при развитии различных хронических патологических процессов, сопровождающихся гибелью нервных или нейроэндокринных клеток, нейронспецифическая енолаза может попадать в кровоток и циркулировать в крови длительный период времени [6].
В настоящее время, определение содержания гамма-енолазы в крови и ликворе уже используется в дифференциальной диагностике и мониторинге различных злокачественных опухолей нейроэндокринного происхождения [6, 9]. Кроме того, содержание НСЕ в крови повышается при ишемических инсультах [3], нейродегенеративных процессах [2], травмах мозга [5] оптической нейропатии [4], сахарном диабете [7]. Результаты исследований содержания НСЕ в крови пациентов с диабетической нейропатией противоречивы. В некоторых исследованиях сообщается о том, что уровень НСЕ не изменяется у пациентов с диабетической нейропатией [11], по результатам более новых работ содержание гамма-енолазы в крови при полинейропатии возрастает и коррелирует с прогрессированием нейропатии [7]. Таким образом, целостной картины, которая объясняла бы изменение концентрации гамма-енолазы в крови при развитии и прогрессии диабетической нейропатии по результатам исследований на людях получить не удалось.
Целью настоящего исследования являлось изучение динамики концентрации нейронспецифической енолазы в крови при прогрессирующем развитии диабетической нейропатии у крыс с модельным сахарным диабетом 1 и 2 типа.
Материал и методы исследования. Экспериментальные животные. Модели сахарного диабета на лабораторных крысах линии Wistar (SPF животные из питомника Пущино). В эксперименте были использованы как самцы, так и самки крыс в возрасте 5-6 месяцев (взрослые), вес животных 200-250 грамм. Всего в эксперименте было использовано 50 животных. В качестве контрольной группы (без диабета) было использовано 10 крыс. Группу животных с сахарным диабетом 1 типа (далее – опытная группа 1 или СД1) составили 20 лабораторных крыс, группа животных с сахарным диабетом 2 типа (далее – опытная группа 2 или СД2) включила в себя 20 крыс. Соотношение по полу в каждой исследуемой группе составило 1:1.
Воспроизведение моделей сахарного диабета 1 и 2 типа. Для индукции сахарного диабета 1 типа у животных опытной группы 1 был применен стрептозотоцин (Sigma Aldrich, США), растворенный в цитратном буфере (pH 4,5) в дозировке 60 мг активного вещества/кг массы тела. Инъекции стрептозотоцина производили интраперитонеально, однократно, при этом животных предварительно вводили в наркоз с помощью изофлурана. Перед проведением инъекций животных держали голодом в течение 24 часов, взвешивание производили непосредственно перед введением стрептозотоцина. Метод был описан в публикации [8].
Для воспроизведения модели сахарного диабета 2 типа у животных на протяжении 6 недель поддерживали обогащенную жирами и фруктозой диету. В качестве источника жиров использовали растительное масло, яйца, сухое молоко, а для введения фруктозы в рацион, в поилки для животных наливали 10 % раствор фруктозы. После 6 недель диеты животным была аналогичным образом произведена однократная инъекция стрептозотоцина, растворенного в цитратном буфере (pH 4,5), однако, в меньшей дозировке: 35 мг/кг массы тела. Для проверки раствора, в котором был растворен стрептозотоцин, группе контрольных животных также интраперитонеально вводили цитратный буфер (без стрептозотоцина) в том же объеме, который вводили крысам из опытной группы Метод индукции диабета 2 типа был описан в статье [13]. При этом инъекцию стрептозотоцина в обеих опытных группах животных обозначили как день 0. Начиная со следующего от инъекции (1 дня) эксперимент продлился 7 недель.
Диагностика сахарного диабета у животных. Развитие сахарного диабета 1 типа у животных было подтверждено через 48 часов после инъекции стрептозотоцина, путем оценки содержания глюкозы в крови. Образцы крови получали из хвостовой вены с использованием гепаринизированных вакутейнеров. Забор крови производили утром, при этом животных с вечера не кормили. Определение содержания глюкозы в плазме крови животных производили ферментативным (глюкозооксидазным) методом с применением набора Новоглюк-К,М, (Вектор-Бест, Россия). Развитие сахарного диабета 2 типа было подтверждено через 5 дней после инъекции стрептозотоцина и поддержания диеты, обогащенной жирами и фруктозой.
Для подтверждения развития сахарного диабета у животных был также проведен тест на толерантность к глюкозе. Животным перорально вводили глюкозу, растворенную в воде в дозировках 2 г/кг массы тела. После чего оценивали изменения содержания глюкозы крови у животных в течение 120 минут, образцы крови забирали каждые 40 минут.
Оценка метаболической декомпенсации. Для оценки метаболической декомпенсации, возникающей у животных в результате развития диабета, измеряли содержание гликозилированного гемоглобина фракции А1с в крови крыс иммунотурбидиметрическим методом с использованием набора Гликогемоглобин (Вектор-бест, Россия). Измерения выполняли на протяжении первого месяца эксперимента, забор крови производили каждые 2 недели.
Подтверждение развития диабетической нейропатии. Для того чтобы подтвердить развитие у экспериментальных животных диабетической полинейропатии было проведено гистологическое исследование дистальных участков седалищных нервов. Перед изъятием нервов животное вводили в наркоз изофлураном и производили декапитацию. После хирургического извлечения участки нервов промывали фосфатным солевым буфером и затем фиксировали в 10 % параформальдегиде. Фиксированные участки нерва затем заливали в парафиновые блоки и резали на микротоме HM 325 (Thermo Scientific, США) на срезы толщиной 5 мкм. Полученные срезы затем окрашивали гематоксилином и эозином и анализировали с помощью светового микроскопа. Дополнительно для подтверждения развития диабетической нейропатии был выполнен тест на гиперчувствительность крыс к температуре. Животных помещали на специальную металлическую платформу, нагретую до 52±0,5 оС и оценивали латентное время, через которое крысы начинали реагировать, пытаясь избежать платформы (облизывали лапы, подпрыгивали).
Анализ содержания нейронспецифической енолазы в крови животных. Забор крови для анализа содержания нейронспецифической енолазы производили один раз в 7 дней, начиная с 1 дня после начала эксперимента. Кровь брали из десны, покрывающей резцы крыс, при этом животное сначала вводили в легкую степень наркоза изофлураном (1-2 минуты), затем делали надрез десны и собирали небольшую (200 мкл) порцию крови в гепаринизированную пробирку. Для оценки содержания нейронспецифической енолазы в сыворотке крови использовали метод иммуноферментного анализа с использованием набора Neuron specific Enolase ELISA Kit (Аbcam, Великобритания). Измерения проводили с помощью планшетного ридера CLARIOstar (BMG LABTECH, Германия).
Статистическая обработка. Для статистической обработки полученных данных применялось программное обеспечение SPSS statistics 17, Graph pad Prism 7, а также стандартный пакет программ Microsoft Exсel. Проверку данных на соответствие нормальному закону распределения проводили с помощью критерия Колмогорова-Смирнова. Описательные статистики для данных, распределенных по нормальному закону представлены в виде среднего (М) и стандартного отклонения (SD). Для сравнения таких данных использовали параметрический критерий Стьюдента. Данные, распределенные по законам отличным от нормального, представлены в виде медианы (Ме) и квартилей (Q1-Q3). Для сравнения использовали непараметрический критерий Манна-Уитни. Различия считали значимыми при доверительном интервале р ≤ 0,05.
Результаты. Развитие сахарного диабета у экспериментальных животных. Развитие сахарного диабета у крыс подтвердилось при оценке содержания глюкозы крови и по результатам теста на толерантность к глюкозе. Так, содержание глюкозы в плазме крови животных контрольной группы составило (M ± SD) 5,33 ± 3,12 ммоль/л. В то же время, содержание глюкозы в крови крыс с СД 1 и СД 2 типа оказалось значительно выше: 18,28 ± 3,63 ммоль/л (р < 0,001) и 16,45 ± 2,57 ммоль/л (р < 0,001) соответственно. При сравнении содержания глюкозы в группах с СД 1 типа и СД 2 типа различий выявлено не было. Результат представлен на графике 1. В ходе проведения теста на толерантность к глюкозе было выявлено нарушение усваивания глюкозы. Через 120 минут после начала эксперимента у животных с СД 1 типа и СД 2 типа концентрация глюкозы в крови не снизилась до изначальных значений (см. график 2). Стоит отметить, что, концентрация глюкозы в крови животных контрольной группы не выходит за пределы референтных значений (для крыс норма 3,0-8,5 ммоль/л) [1].
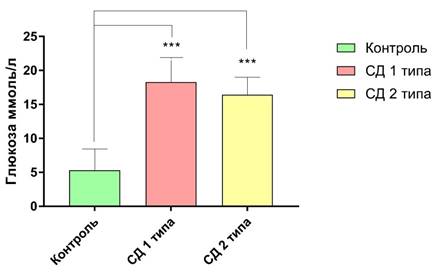
Рисунок 1. Содержание глюкозы в крови животных с экспериментальными моделями сахарного диабета.
Где *** - р <0,001
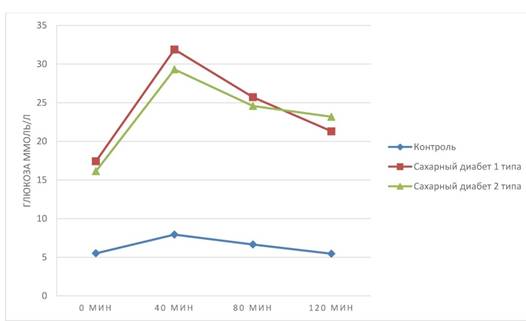
Рисунок 2. Результаты глюкозотолерантного теста
Степень метаболической декомпенсации. Дополнительно для оценки уровня гликемии и оценки риска развития осложнений сахарного диабета у животных было определено содержание гликозилированного гемоглобина А1с. В контрольной группе животных содержание гликозилированного гемоглобина не превышало 5 %, значение составило (Me (Q1-Q3)) 4,10 % (3,72 - 4,75). У животных опытной группы 1 и 2 на момент начала эксперимента (за 1 день до инъекции стрептозотоцина) содержание гликозилированного гемоглобина составило 3,94 % (3,61 - 4,59) и 4,10 % (3,82 - 4,27) соответственно. Через 2 недели от начала эксперимента содержание гликозилированного гемоглобина в крови крыс с СД 1 типа и в крови животных с СД 2 типа оказалось значительно выше, чем в контроле: 11,05 % (9,46 – 12,99), (р < 0,001) и 10,79 % (9,18 – 11,38), (р < 0,001) соответственно. Через месяц после начала эксперимента содержание гликозилированного гемоглобина у животных с СД 1 возросло до 14,81 % (10,41 – 14,99), (р <0,001) и до 14,69 % (12,03 – 14,82), (р <0,001) у крыс с СД 2 типа. Высокое содержание гемоглобина А1с свидетельствует о наличии метаболической декомпенсации, длительной гипергликемии и высоком риске развития осложнений сахарного диабета.
Возникновение диабетической полинейропатии. Результаты проведенного гистологического исследования представлены на рисунке 1.
По результатам гистологического исследования в срезах седалищного нерва животных контрольной группы патологических изменений на всем протяжении эксперимента выявлено не было. Миелинизированные нервные волокна одинаковые по размеру. Миелиновая оболочка нервных волокон плотная, равномерной толщины, упорядоченной структуры, без набуханий. Стенки эндонейральных капилляров не утолщены. У животных c сахарным диабетом как 1, так и 2 типа первые признаки нейродегенерации, атрофии аксонов и демиелинизации нервных волокон появляются после 2 недели эксперимента.
На всем протяжении эксперимента (7 недель) наблюдалось нарастание степени патологических изменений в седалищном нерве животных с сахарным диабетом. К концу 7 недели эксперимента во всех образцах ткани седалищного нерва животных с сахарным диабетом было обнаружено уменьшение диаметра нервов (свидетельствует об уменьшении количества нервных волокон), общая дезорганизация структуры нервов, атрофия аксонов, вакуолизация и демиелинизация нервных волокон (См. рисунок 1, C и D).
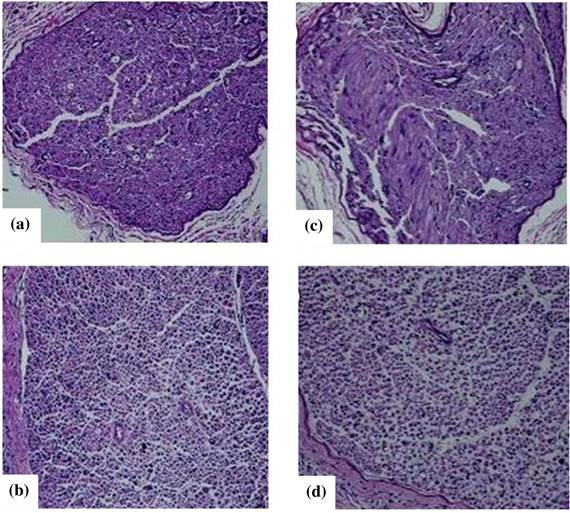
Рисунок 3. Результаты гистологического исследования, где A и B поперечный срез седалищного нерва крысы из контрольной группы. A – увеличение х200, B – увеличение х 400. Фотомикрографии C и D – седалищный нерв крысы с сахарным диабетом: диабетическая нейропатия 7 неделя эксперимента. Увеличение соответственно C – х200, D – х400. Окрашивание гематоксилином и эозином
Миелиновая оболочка миелинизированных нервных волокон тонкая, рыхлая неравномерной толщины. Ламеллярные пространства были расширены и отдалены друг от друга, были выявлены видимые признаки атрофии аксонов. Стенки эндонейральных капилляров утолщены, просвет капилляров неравномерный. Гистологическая картина срезов седалищного нерва у животных с сахарным диабетом 1 типа и сахарным диабетом 2 типа на всех этапах эксперимента была неразличима.
По результатам теста на температурную гиперальгезию начальные признаки нейропатии наблюдаются уже после первой недели экспериментального сахарного диабета. Латентное время избегания горячей платформы у животных с СД 1 типа 4,3 ± 2,3 сек и 4,6 ± 1,7 сек у крыс с СД 2 типа значительно меньше у животных контрольной группы 7,4 ± 2,1 сек (р < 0,05), что свидетельствует о снижении порога болевой чувствительности и является признаком нейропатии.
Содержание нейронспецифической енолазы в крови и ее связь с диабетической нейропатией. Результаты анализа содержания нейронспецифической енолазы в целом отражают изменения, происходящие в нервных волокнах животных опытной группы 1 и 2. Содержание гамма-енолазы в крови животных контрольной группы на протяжении всего эксперимента не превышало 10,00 нг/мл. При этом концентрация НСЕ Me (Q1-Q3) в крови животных опытной группы 1: 8,79 (6,98 – 10,79) и группы 2: 8,57 (6,47 - 10,74) в первую неделю от начала эксперимента не отличалось от контроля 8,53(6,39 - 9,36).
Однако уже на второй неделе после индукции диабета концентрация гамма-енолазы в крови животных с СД 1 типа 9,46 (7,23 - 11,53) и с СД 2 типа 9,51 (7,68 - 11,99) оказалась значительно выше (р < 0,05) по сравнению с контрольной группой 8,42 (6,50 - 8,98). Тенденция к повышению содержания НСЕ в крови животных с сахарным диабетом оставалась на всем протяжении эксперимента. К 7 неделе эксперимента концентрация НСЕ в крови крыс с сахарным диабетом 1 типа составила 12,94 (7,69 - 14,25), у животных с сахарным диабетом 2 типа – 11,76 (8,32 - 13,19), что значительно выше (р < 0,001), чем в контрольной группе 8,59 (6,77 – 9,16). Более подробно результаты оценки НСЕ в крови экспериментальных животных представлены на графике 3.
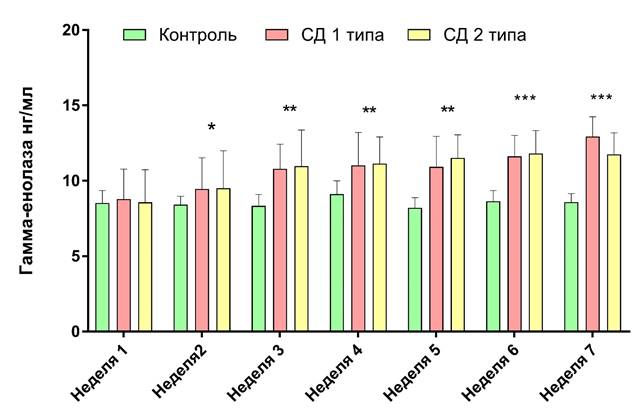
Рисунок 4. Содержание нейронспецифической енолазы в крови крыс линии Wistar с экспериментальной моделью стрептозотоцин-индуцированного сахарного диабета 1 и 2 типа. Где * - р <0,05, **- р <0,01, ***- p <0,001
Для того чтобы определить наличие статистически значимой связи между содержанием нейронспецифической енолазы в крови и признаками нейропатии мы использовали корреляционный критерий Пирсона. В качестве признаков нейропатии были использованы результаты теста на температурную гиперчувствительность. В результате оценки корреляции по Пирсону между содержанием НСЕ и признаками нейропатии была определена положительная (прямая) корреляционная связь средней силы, значение 0,68 с доверительным интервалом р = 0,001.
Обсуждение. В результате проведенного эксперимента на крысах линии Wistar были воспроизведены модели сахарного диабета 1 и 2 типов. Развитие сахарного диабета у животных было подтверждено в соответствии с современными рекомендациями эндокринологов. Развитие диабетической нейропатии было выявлено с помощью теста на температурную гиперчувствительность, а также подтверждено с помощью гистологического исследования участков седалищных нервов крыс.
По результатам теста на гиперчувствительность начальные признаки нейропатии наблюдаются уже после первой недели сахарного диабета. Гистологические изменения нервных волокон можно определить в конце 2 недели развития сахарного диабета.
Патологические изменения отражают развитие нейропатии и носят прогрессирующий характер. К моменту окончания эксперимента в образцах нервной ткани животных с сахарным диабетом наблюдались отчетливые признаки диабетической нейропатии: демиелинизация и атрофия нервных волокон.
Несмотря на то, что по результатам теста на гиперальгезию изменения чувствительности выявлены уже на 1 неделе эксперимента, повышение содержания нейронспецифической енолазы в крови крыс с моделью экспериментального сахарного диабета 1 и 2 типов соответствует возникающим ранним изменениям в нервных волокнах на гистологическом уровне. При этом содержание гамма-енолазы остается повышенным до конца эксперимента.
Была определена статистически значимая прямая корреляционная связь между содержанием НСЕ в крови и прогрессированием нейропатии, возникающей при сахарном диабете. Пороговое значение содержания гамма-енолазы в крови для ранней диагностики диабетической полинейропатии у крыс по результатам наших исследований составляет 9,8 нг/мл.
Таким образом, результаты нашего исследования демонстрируют, что уровень нейронспецифической енолазы в крови животных с модельным сахарным диабетом повышается и может отражать ранние гистологические изменения в периферических нервах.
При этом содержание гамма-енолазы не различается статистически при сравнении разных типов диабета, но значимо выше по сравнению с контролем, что предоставляет возможность в перспективе использовать гамма-енолазу в качестве биомаркера для ранней диагностики полинейропатии, как при сахарном диабете 1 типа, так и при сахарном диабете 2 типа.
Принимая во внимание, что данное исследование было проведено на экспериментальных животных мы считаем, что для более полной картины связи содержания НСЕ в крови с диабетической нейропатией необходимо дополнительно изучить этот вопрос. Однако наш эксперимент в полной мере подтвердил результаты исследований других научных групп, проведенных с использованием крови пациентов-людей с диабетической нейропатией [7, 12].


