Синтез и свойства динитропроизводных бензимидазола
Конференция: XLI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Биоорганическая химия

XLI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Синтез и свойства динитропроизводных бензимидазола
SINTHESIS AND PROPERTIES OF DINITRO DERIVATIVES OF BENZIMIDAZOLES
Yuliya Vlasova
PhD in chemistry, Associate Professor of the Department of Chemistry, Tula State Lev Tolstoy Pedagogical University, Russia, Tula
Loik Mukhtorov
PhD in chemistry, Researcher of the Department of Chemistry, Tula State Lev Tolstoy Pedagogical University, Russia, Tula
Tatyana Demidova
Student, Tula State Lev Tolstoy Pedagogical University, Russia, Tula
Yuri Atroshchenko
Doctor of chemistry, Professor, Chief Researcher of the Department of Chemistry, Tula State Lev Tolstoy Pedagogical University, Russia, Tula
Аннотация. В результате пятистадийного синтеза из фенола получены динитропроизводные бензимидазола. Их строение доказано методом ЯМР1Н-спектроскопии. Исследован спектр биологической активности, а также токсичности синтезированных структур и их аналогов посредством программ PASS и GUSSAR. Проведен анализ на фунгицидную активность по отношению к грибам, вызывающим болезни растений.
Abstract. As a result of a five-step synthesis from phenol, dinitro derivatives of benzimidazole were obtained. Their structure has been proven by 1H NMR spectroscopy. The spectrum of biological activity, as well as the toxicity of the synthesized structures and their analogs, was studied using the PASS and GUSSAR programs. An analysis was carried out for fungicidal activity in relation to fungi that cause plant diseases.
Ключевые слова: динитропроизводные бензимидазола; ЯМР 1Н-спектроскопия; фунгицидная активность.
Keywords: dinitro derivatives of benzimidazole; 1H NMR spectroscopy; fungicidal activity.
Биологические свойства бензимидазола и его производных обсуждают длительное время. Впервые о 5,6-диметилбензимидазоле стало известно как о продукте распада витамина B12 [1]. В 1955 году при расшифровке пространственной конфигурации B12 было установлено, что в его состав входит N-рибозил-диметилбензимидазол, координирующий кобальт в соединении [2].
Было установлено, что бензимидазол и его производные эффективны в борьбе с некоторыми микроорганизмами и проявляют фунгицидную активность [3]. В 1962 году было лицензировано первое производное бензимидазола в качестве фармацевтического препарата – тиабендазол (антигельминтное средство).
Поскольку биологические свойства бензимидазола и его производных разнообразны, данные вещества являются оптимальной базой для создания новых лекарственных средств и представляют интерес для науки.
Начальным веществом для синтеза был фенол 1, нитрованием которого (HNO3 конц.+ олеум) была получена пикриновая кислота 3. На следующей стадии под действием оксихлорида фосфора в ДМФА в соединении 3 была замещена ОН-группа на хлор (4) с целью дальнейшего ее замещения на аминогруппу, которое происходило в среде пропанола под действием газообразного аммиака. В результате чего был получен 2,4,6-тринитроанилин 5. Одну из нитрогрупп селективно восстанавливали при пропускании газообразного сероводорода 6. Циклизация в целевой бензимидазол 7 происходила при кипячении 3,5-динитробензол-1,2-диамина 6 с хлорангидридом уксусной кислоты в присутствии соляной кислоты в течении 12 часов (Рисунок 1).
Контроль за ходом реакции и чистотой продуктов осуществлялся с помощью тонкослойной хроматографии (ТСХ), элюент – толуол: ацетон: гептан: уксусная кислота = 4:1:1:0,5.
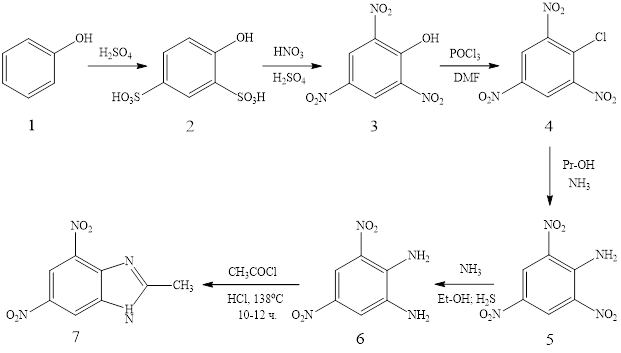
Рисунок 1. Ход реакции получения целевого соединения
Строение промежуточных соединений и целевого продукта 7 было доказано методом ЯМР 1Н-спектроскопии. Так в спектре полученного 2-метил-4,6-динитро-1Н-бензо[d]имидазола в ароматической области мы можем видеть два дублета соответствующих протонам Н5 и Н7 при δ 9,00 и δ 8,875 м.д. соответственно с константой спин-спинового взаимодействия 4J=1,6 Гц. В области алифатических протонов при δ 2,82 м.д. фиксируется синглет трех эквивалентных протонов метильной группы.
На следующем этапе работы был проведен виртуальный анализ биологической активности и токсичности, а также микробиологическое исследование на фунгицидную активность in vitro синтезируемых соединений, и их структурных аналогов, полученных нами ранее.
Спектр биологической активности изучали с помощью системы PASS.
Нами были выделены 7 видов активности, проявляемых с высокой степенью вероятности (56-85%) (Диаграмма 1).

Рисунок 2. Спектр биологической активности
Также нами были отмечены некоторые зависимости свойств от структуры изучаемых соединений. Так, например, незамещенный бензимидазол обладает более высокой степенью вероятности, чем замещенный по атому азота метильной группой. Введение в молекулу дополнительного бензольного кольца снижает вероятность проявления выбранных свойств, а содержание карбоксильной группы напротив ее увеличивает.
Согласно ГОСТу 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности», все вещества делятся на классы опасности. В качестве критерия используется полулетальная доза ЛД50 (мг/кг массы тела). С целью выявления у исследуемых структур токсичности, нами был проведен виртуальный анализ в системе GUSAR. Прогнозировалась острая токсичность для крыс при пероральном, внутривенном, внутрибрюшинном и подкожном введении (Диаграмма 2).

Рисунок 2. Прогноз острой токсичности для крыс
По полученным данным можно сделать вывод, что вещества являются малотоксичными и в основном относятся к 4 классу опасности.
Исследование на наличие противогрибковой активности in vitro проведено в лаборатории микробиологии ТГПУ им. Л.Н. Толстого. Растворы исследуемых веществ были проверены на семи грибах-фитопатогенах: Venturia inaequalis, Bipolaris sorokiniana, Fusarium oxysporum, Fusarium moniliforme, Sclerotinia sclerotiorum, Alternaria alternata, Rhizoctonia solani.
Полученные данные однозначно показывают, что синтезированные образцы веществ проявляют хорошие фунгицидные свойства (более 50%). Наибольшее подавление роста достигается для видов Rhizoctonia solani и Bipolaris sorokiniana (70-87%), а наименьшее подавление – для грибов вида Fusarium oxysporum.

