Поиск новых ингибиторов ионного канала p7 вируса гепатита C в ряду адамантансодержащих соединений
Конференция: XXIX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Медицинская химия

XXIX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Поиск новых ингибиторов ионного канала p7 вируса гепатита C в ряду адамантансодержащих соединений
SEARCH FOR NEW INHIBITORS OF HEPATITIS C VIRUS P7 ION CHANNEL IN THE SERIES OF ADAMANTANE CONTAINING COMPOUNDS
Vadim Shiryaev
Candidate of Chemical Sciences, associate Professor, Samara State Technical University, Russia, Samara
Marat Baimuratov
Candidate of Chemical Sciences, senior researcher, Samara State Technical University, Russia, Samara
Marina Leonova
Candidate of Chemical Sciences, associate Professor, Samara State Technical University, Russia, Samara
Yuri Klimochkin
Doctor of Chemical Sciences, Head of the Department of Organic Chemistry, Samara State Technical University, Russia, Samara
Аннотация. В настоящее время интенсивно развиваются исследования, связанные с поиском соединений-лидеров, нацеленных на определенный круг мишеней и способных стать прообразом новых лекарственных средств. Одним из направлений в мировой науке в этой области является поиск веществ с антивирусной активностью в ряду каркасных соединений. В рамках данного исследования нами была создана виртуальная библиотека каркасных соединений, различающихся расположением и комбинацией функциональных групп в боковой цепи, а также наличием или отсутствием ароматических, или гетероароматических фрагментов. Проведена оценка связывания потенциальных биологически активных соединений полиэдрановой структуры с ионным каналом p7 вируса гепатита C с помощью молекулярного докинга. По результатам проведенного докинга найдено 16 наиболее перспективных структур – винилдигидрофураны, дигидробензоксепины и пирролины адамантанового ряда.
Abstract. Currently, research is being intensively developed related to the search for leader compounds aimed at a specific range of targets and capable of becoming a prototype of new drugs. One of the directions in world science in this area is the search for substances with antiviral activity in a number of cage compounds. In this study, we created a virtual library of cage compounds that differ in the location and combination of functional groups in the side chain, as well as the presence or absence of aromatic or heteroaromatic fragments. The binding of potential biologically active compounds of the polyhedran structure to the hepatitis C virus p7 ion channel was evaluated using molecular docking. According to the results of the docking, 16 most promising structures were found – vinyl dihydrofurans, dihydrobenzoxepines and pyrroline of adamantane series.
Ключевые слова: каркасные соединения; антивирусная активность; гепатит C; молекулярный докинг; ионный канал p7; адамантан; олефины; гетероциклические соединения.
Keywords: cage compounds; antiviral activity; Hepatitis C; molecular docking; p7 ion channel; adamantane; olefins; heterocyclic compounds.
В настоящее время интенсивно развиваются исследования, связанные с поиском соединений-лидеров, нацеленных на определенный круг мишеней и способных стать прообразом новых лекарственных средств. Одним из направлений в мировой науке в этой области является поиск веществ с антивирусной активностью в ряду каркасных соединений, о чем свидетельствуют многочисленные публикации зарубежных групп исследователей за последние годы [1, 2].
Разработанные на сегодняшний день методы молекулярного моделирования направлены на «рациональное» создание химических веществ с заданным типом биологической активности, в частности на выявление наиболее активных ингибиторов ионных каналов вирусов [3]. С другой стороны, эффективные методы органического синтеза позволяют получать принципиально новые соединения каркасной структуры с заранее заданной архитектурой молекулы и геометрией каркасного фрагмента.
На сегодняшний день не только в России, но и повсеместно отчетливо наблюдается преобладание заболеваний вирусной этиологии в общей структуре инфекционной патологии. При этом основными среди них являются острые вирусные респираторные заболевания, вирусные гепатиты, заболевания, вызываемые герпесвирусами. Среди этих, наиболее массовых групп инфекций, распространена и приносит значительный ущерб здоровью населения инфекция, вызываемая вирусами гепатита. Гепатит С является общемировой проблемой. Примерно 3% населения мира (около 180 млн. человек) инфицированы, и каждый год фиксируется 3-4 миллиона новых случаев заражения гепатитом С. Лекарственные средства в виде специфических ингибиторов репродукции вирусов для лечения и профилактики значительной части заболеваний инфекционной вирусной патологии до настоящего времени отсутствуют или их арсенал весьма ограничен. Кроме того, проблема недостаточности современных противовирусных средств усугубляется развитием лекарственной устойчивости, что особенно актуально в случае вирусных гепатитов, требующих длительного применения препаратов. Преодоление этих проблем возможно путем применения новых противовирусных средств с отличающимся механизмом действия.
Следует отметить тот факт, что в настоящее время в США и странах ЕЭС одобрены и вводятся в медицинскую практику препараты в отношении вируса гепатита C – гразопревир, глекапревир, воксилапревир, софосбувир, симепревир, даклатасвир, дасабувир, а также комбинации софосбувира, велпатасвира и воксилапревира («Восеви»), паритапревира с омбитасвиром и ритонавиром [4], однако стоимость таких новейших препаратов не позволяет говорить об их доступности для большинства населения РФ. Таким образом, очевидна актуальность разработки низкомолекулярных ингибиторов вирусной репродукции.
Поскольку p7 канал необходим для размножения вируса гепатита C, то он является потенциальной целью для дизайна новых лекарственных препаратов. В работе [5] был проведен виртуальный скрининг более 250 тысяч соединений с высоким прогнозируемым сродством к адамантановому сайту связывания белка p7. Несколько структур показали значительное улучшение активности по сравнению с амантадином.
Исследование взаимосвязи структура-активность привели к еще большему уменьшению ингибирующей концентрации и появлению активности в отношении нескольких штаммов вируса гепатита С. Такие ингибиторы представляют значительный интерес для разработки эффективных кандидатов на роль лекарственных препаратов против вируса гепатита С. Последующая проверка in vitro позволила обнаружить три соединения, с более высокой ингибирующей активностью, чем римантадин [5].
В рамках данного исследования нами была создана виртуальная библиотека каркасных соединений (200 структур), различающихся расположением и комбинацией функциональных групп в боковой цепи, а также наличием или отсутствием ароматических, или гетероароматических фрагментов. Структуры были предложены на основании анализа литературных данных, в том числе по структурному сходству с известными активными соединениями.
Для проведения оценки связывания потенциальных биологически активных веществ с белками-мишенями РНК-геномных вирусов при помощи молекулярной динамики (программа NAMD 2.11) была смоделирована и оптимизирована структура ионного канала P7 вируса гепатита C (рис. 1).
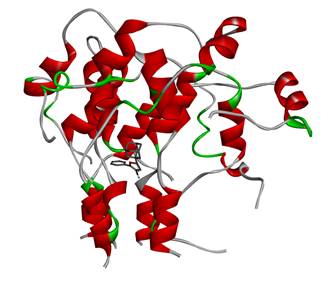
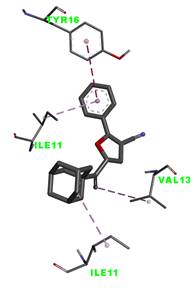
Рисунок 1. Комплекс соединения 1 с ионным каналом p7 вируса гепатита C
Далее была проведена оценка связывания потенциальных биологически активных соединений полиэдрановой структуры c ионным каналом p7 вируса гепатита C при помощи молекулярного докинга в программе AutoDock Vina. Были определены значения свободных энергий связывания для всех структур и в результате найдены 3 лиганда, которые показали высокие значения взаимодействия с ионным каналом и 13 соединений, показавшие умеренное взаимодействие с ионным каналом p7 (Таблица 1).
Таблица 1.
Структуры, показавшие наименьшие свободные энергии связывания с ионным каналом p7 в ходе молекулярного докинга 1-205 и 21-2368
|
Структура |
p7 |
Структура |
p7 |
|
Энергия связывания, ккал/мол |
Энергия связывания, ккал/мол |
||
|
|
-9,03 |
10 |
-8,85 |
|
|
-8,57 |
|
-8,63 |
|
|
-8,47 |
|
-8,47 |
|
|
-8,78 |
|
-8,63 |
|
|
-8.70 |
|
-8,63 |
|
|
-8,75 |
|
-8,90 |
|
|
-9,25 |
|
-8,57 |
|
|
-9,35 |
|
-8,57 |
Заключение. Таким образом, заметная активность каркасных соединений в отношении вируса гепатита C, показанная при помощи молекулярного докинга, дает возможность считать, что важный вклад вносит полициклический каркас. Также, следует отметить, что перспективными ингибиторами вируса гепатита C являются 10-ти членные гетероциклы содержащие 2 адамантановых фрагмента, которые показали сильное связывание с ионным каналом p7 вируса гепатита C. Также перспективными биологически активными соединениями, исходя из данных докинга, являются винилдигидрофураны, дигидробензоксепины и пирролины адамантанового ряда.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект РФФИ 18-33-00994 мол_а).


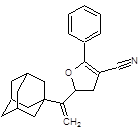 1
1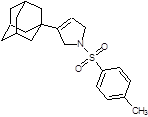
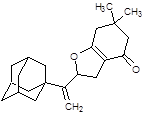 2
2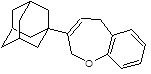 11
11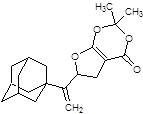 3
3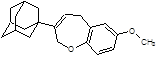 12
12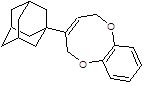 4
4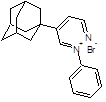 13
13 5
5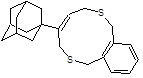 14
14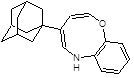 6
6 15
15 8
8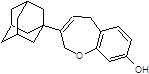 16
16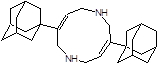 9
9
