Синтез промежуточного продукта феромона Grapholita molesta
Конференция: XXVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Биоорганическая химия

XXVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Синтез промежуточного продукта феромона Grapholita molesta
Аннотация. Феромоны являются одной из составляющих низкомолекулярных биорегуляторов с относительно небольшой молекулярной массой, высокой биологической активностью и выполняющих разнообразные функции в живых организмах. Известные на сегодняшний день феромоны насекомых представляют собой молекулы линейной структуры с содержанием не более четырех асимметрических центров. В связи с этим теоретический и практический интерес представлял синтез и исследование 8-цис,транс-додеценилацетата.
Ключевые слова: феромон насекомых; биологически активные вещества; агроэкосистема; стадии синтеза; оптимизация; ИК-спектроскопия.
Введение. В последние десятилетия в науке и практике сельского и лесного хозяйства сложилась и активно развивается концепция системы интегрированной защиты растений, в которую как нельзя лучше вписывается применение феромонов – биологически активных веществ, вырабатываемых самими насекомыми для передачи информации особям своего вида [1-3].
Научившись синтезировать феромоны искусственно, человек получил возможность «приказывать» насекомым, контролировать их поведение. Самым простым и очевидным способом использовать эту уникальную возможность является «приказ» вредителям отправляться в ловушки. Таким образом, можно либо полностью избавиться от них, либо точно определить момент их появления и количество, чтобы далее выработать эффективный план борьбы.
Используя синтетические вещества, идентичные по строению и составу природным феромонам, возможна организация управления численностью популяцией определенного вида насекомых фитофагов с целью поддержания ее на разумном уровне, сохраняя баланс агроэкосистемы [4-6].
Этот подход лишен недостатков, которые присущи использованию различных ядохимикатов. При использовании феромонов не происходит привыкания насекомых к применяемым препаратам [7-10].
Поэтому, приоритетным направлением исследований является синтез веществ идентичных феромонам насекомых для регулирования их численности.
C целью получения промежуточных продуктов синтеза аналога феромона нами проведены исследования по оптимизации стадий синтеза. При этом было исследовано влияние концентрации веществ, природы реагентов и растворителя, а также, продолжительность реакции на эффективность процесса.
Синтез конечного продукта аналога феромона насекомых протекает ступенчато, который можно изобразить следующим образом:
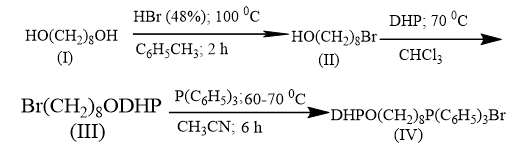
Обсуждение результатов. Для подтверждения структуры синтезированных соединений были использованы методы ИК-спектроскопии.
При изучении ИК-спектра 1,8-октандиола (I) наблюдаются валентные колебания следующих функциональных групп: НО- при 3650-3200 см-1, -СН- при 3000-2840 см-1, С-О при 1260-970 см-1, скелетные и деформационные колебания –СН2– группы соответственно при 720-770 см-1 и 1475-1450 см-1, деформационные колебания С-ОН группы при 1475-1315 см-1 (Рисунок 1).
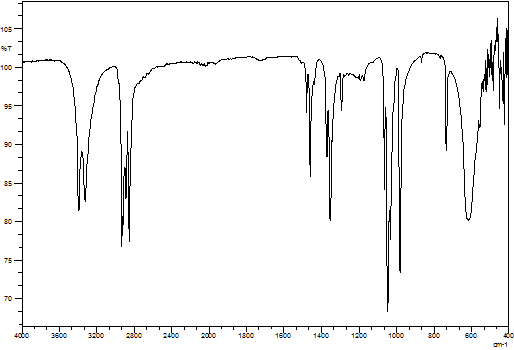
Рисунок 1. ИК-спектр 1,8-октандиола (I)
В спектре 8-бромоктанола-1 (II) наблюдаются: широкая полоса валентных колебаний –ОН группы при 3650-3200 см-1, валентные колебания –СН- группы при 3000-2840 см-1, скелетные и валентные колебания -СН2- группы соответственно при 720-770 см-1 и 1475-1450см-1, валентные колебания С-Вr группы при 1080-1000 см-1 и 700-500 см-1 (Рисунок 2).
В ИК-спектре защищенного 8-бромоктанола-1 - 2-(8-бромоктилокси) -тетрагидро-2Н-пирана (III) отсутствуют полосы поглощения, характерные для гидроксильной группы 8-бромоктанола-1 (II). В спектре при 3000-2840 см-1 наблюдаются валентные колебания -СН- группы, скелетные и деформационные колебания наблюдаются соответственно при 720-770 см-1 и 1475-1450 см-1, валентные колебания -С-О группы проявлются при 1190-990 см-1, асимметричные и симметричные колебания С-О-С группы наблюдаются соответственно при 1310-1230 см-1 и 1055-870 см-1, валентные колебания С-Вr группы проявляются при 1080-1000 см-1 и 700-500 см-1.
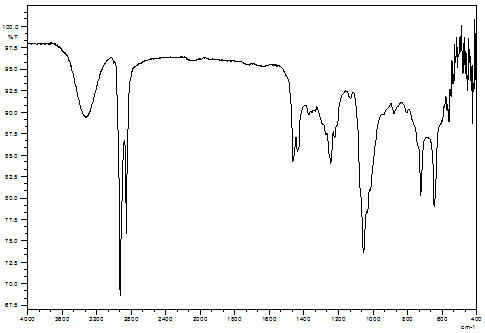
Рисунок 2. ИК-спектр 8-бромоктанола-1 (II)
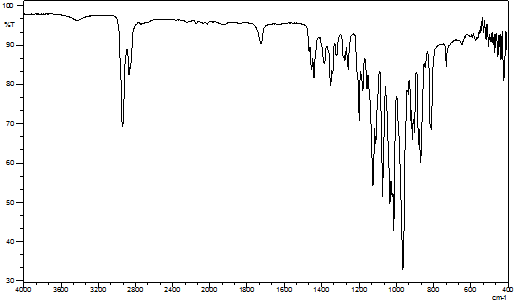
Рисунок 3. ИК-спектр 2-трифенилфосфиноктилокси-тетрагидро-2Н-пиранбромида (IV)
В ИК-спектре комплексной соли – 2-трифенилфосфиноктилокси-тетрагидро-2Н-пиранбромида (IV) валентные колебания P-C6H5 групп наблюдаются при 1110-1340 см-1, валентные колебания фенильных групп проявляются при 1600-1575 см-1, валентные колебания -СН- и -С-О групп наблюдаются соответственно при 3000-2840 см-1 и 1190-990 см-1, скелетные и деформационные колебания -СН2- группы проявляются соответственно при 720-770 см-1 и 1475-1450 см-1, асимметричные и симметричные колебания С-О-С группы наблюдаются соответственно при 1310-1230 см-1 и 1055-870 см-1 (Рисунок 3). Отсутствие валентных колебаний С-Вr группы, в отличие от других групп бромоктанола, свидетельствует о том, что получился 2-трифенил- фосфиноктилокси-тетрагидро-2Н-пиранбромид.
Заключение.
1. Определены оптимальные условия проведения двух стадий синтеза, подтверждено строение полученных промежуточных соединений методом ИК-спектроскопии.
2. Проведены исследования по оптимизации стадий синтеза. Исследовано влияние концентрации и природы реагентов, природы растворителя, температуры и продолжительности реакции на эффективность процесса.
4. Определены оптимальные условия защиты хлор- и бромоктанолов дигидропираном в среде хлороформа.


