Кристаллохимия как один из фундаментальных разделов в минералогии
Конференция: XXVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Биогеохимия

XXVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Кристаллохимия как один из фундаментальных разделов в минералогии
Аннотация. Представлен краткий обзор данных о закономерностях и особенностях кристаллической структуры минералов.
Ключевые слова: кристаллохимия; минералы; кристаллы.
Основательно кристаллохимия как наука была основана, благодаря особенностям кристаллической структуры минералов, т.к. они напрямую зависят от его химического состава. Ученые пришли к этому выводу, с помощью накопления рентгенографических данных. Они сопоставили их и результаты химических анализов, и тем самым выявили данную закономерность минерального строения структуры и химического состава.
В минералогии принято считать химические элементы «чистыми», если они встречаются в самородном виде. К данным элементам, например, относят серебро, золото и медь, и главной их отличительной особенностью служит тот факт, что они, в отличие от большинства, построены из атомов обладающих электронейтральными способностями. Так как атомы не самородных элементов несут электрический заряд и называются ионами, притяжение между противоположно заряженными ионами называется ионной связью и служит главной связующей силой в минералах [1, 115].
Рассмотрим другой тип связи, например, внешние электроны вращаются вокруг ядер по общим орбитам тем самым соединяя атомы между собой. Элементы, обладающие данным типом связи, а именно ковалентной связью, отличаются своей твердостью и обладают высокой температурой плавления. К данному типу относится алмаз.
Но есть также слабая ван-дер-ваальсова связь в минералах. Она происходит между электронейтральными структурными единицами, и играет наименьшую роль в строении минералов, т.к. энергия распределена неравномерно. Ван-дер-ваальсова связь обеспечивает притяжение между противоположно заряженными участками в более крупных структурных единицах.
Атом при недостаточном количестве электронов носит название – катион, потому что имеет положительный заряд, а если же атом имеет достаточное большое количество электронов, тогда он будет, в данном случае, называться анионом, и соответственно, будет иметь при этом отрицательный заряд.
Выражение «противоположности притягиваются» взято именно из определенной закономерности: противоположно заряженные ионы всегда имеют свойство сближаться. В данном случае расстояние между ними составляет прямо пропорционально силу отталкивания, и тем самым уравновешивает силу притяжения. Точнее говоря, критическое расстояние предложенной пары «катион-анион», прямо пропорционально равно сумме радиусов этих двух ионов, и это расстояние измеряется только в нанометрах (нм) (рис. 1-а). Их ионные связи представлены в виде шаров, которые плотно соприкасаются друг с другом. Именно таким образом они выглядят [1, 117].
Величина размеров ионов и знака заряда являются основными элементными характеристиками структуры ионных кристаллов минералов. Поскольку, кристалл электронейтрален, тогда сумма положительных зарядов равна сумме отрицательных зарядов но, так или иначе, присутствует и дифференциация количества заряженных ионов в некоторых видах минералов.
Возможность вхождения ионов в кристаллическую структуру, напрямую зависит от величины этих ионов. При условии если они имеют одинаковую величину, и упакованность выглядит тем образом, что ионы плотно соприкасаются друг с другом, а именно с 12 другими, это служит доказательством того, что они находятся в определенной координации.
Выделяют два способа упаковки шаров одинакового размера:
- Гексагональная, при данной плотнейшей упаковке происходит образование гексагональных кристаллов;
- Кубическая, при данной упаковке происходит образование изометрических кристаллов (рис. 1-б).
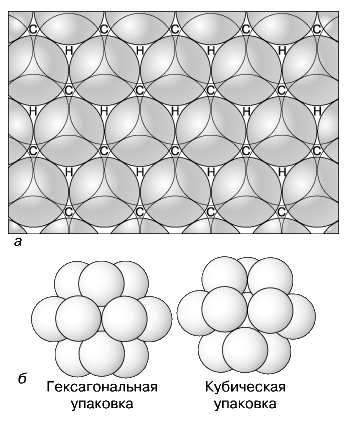
Рисунок 1. Упаковка шаров ионов в минеральных структурах: а) радиусное расположение ионов; б) упаковка шаров ионов в кристаллической структуре минералов гексагональная и кубическая
В силу закономерности установлено, что размеры катионов меньше, чем анионов. Их размеры выражаются в долях радиуса, принятой за единицу, в результате деления радиуса катиона на радиус аниона. При условии, что катион немного меньше анионов, т.е. соприкасается с восьмью анионами. Данное явление называется восьмерной координацией (кубическая координация). Они располагаются вокруг, на вершинах куба. Данное расположение устойчиво при отношении ионных радиусов от 1 до 0,732, показано на рисунке 2 (а). Меньшее же соотношение радиусов ионов, значительно меняет геометрию упаковки. В данном случае она приобретает шестерную координацию катионов с расположением анионов в шести вершинах октаэдра, при отношениях их радиусов от 0,732 до 0,416, представлено на рисунке 2 (б). Она же отличается своей устойчивостью. Впоследствии уменьшения размера катиона, шестерная координация сводится к четверной, при значениях отношений радиусов от 0,414 до 0,225 (рис. 4, в), или тетраэдрической, в пределах отношений радиусов от 0,225 до 0,155 (рис. 4, г), а затем и к двойной координации, при отношениях радиусов менее 0,155 (рис. 4, д). Для большинства минералов закономерное последовательное отношение радиусов ионов является прогнозирующей способностью кристаллических структур [1, 118].

Рисунок 2. Координация ионов минералов: а) восьмерной координацией ионов; б) шестерную координацию ионов; в) четверная координация ионов; г) тройная координация ионов; д) двойная координация ионов
Минералы различного химического состава имеют одни и те же структуры. Примеси в минералах зачастую присутствуют в виде ионов. Они являются заместителями ионов минерала «хозяина». Данные замещения влияют на размеры ионов. Таким образом, если радиусы ионов равны или же имеют различия при условии, что подобные различия колеблются в пределах до 15%, в таком случае они могут быть легко заменяемыми. При различиях до 30%, замещение ионов принимает ограниченное взаимодействие, а при различии свыше 30% замещение и вовсе считается невозможным.
Можно привести пример пару изоструктурных минералов со сходным химическим составом, между которыми происходит замещение ионов. Данным примером могут служить карбонаты сидерит (FeCO3) и родохрозит (MnCO3), они имеют одинаковые структуры, в основе лежащие марганец и железо имеют свойство замещать друг друга, образуя в результате твердые растворы. Между этими двумя минералами существует непрерывный ряд твердых растворов. В других парах минералов ионы возможности взаимного замещения ограничены.
Поскольку минералы электронейтральны, заряд ионов также влияет на их взаимное замещение. Если происходит замещение противоположно заряженным ионом, то в каком-либо участке этой структуры должно иметь место второе замещение, при котором заряд замещающего иона компенсирует нарушение электронейтральности, вызванное первым. Такое сопряженное замещение отмечается в полевых шпатах – плагиоклазах, когда кальций (Ca2+) замещает натрий (Na+) с образованием непрерывного ряда твердых растворов. Избыточный положительный заряд, возникающий в результате замещения ионом Ca2+ иона Na+, компенсируется путем одновременного замещения кремния (Si4+) на алюминий (Al3+) в соседних участках структуры [1, 124].


