Патологии деления в культуре клеток дермальной папиллы кролика после криоконсервирования
Конференция: XXVIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Клеточная биология, цитология, гистология

XXVIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Патологии деления в культуре клеток дермальной папиллы кролика после криоконсервирования
Аннотация. В статье рассмотрены патологии митоза и нарушения клеток в интерфазе, возникающие в диплоидной культуре клеток вибрисс кроликов после криоконсервирования и дальнейшего субкультивирования. В качестве криозащитных, используется ряд сред с повышающейся концентрацией диметилсульфоксида и белково-пептидными добавками.
Ключевые слова: дермальная папилла; криоконсервирование; диметилсульфоксид, культура клеток; патологии митоза; апоптоз.
Введение. Клетки дермальной папиллы (ДП) – уникальный пул плюрипотентных клеток-производных нервного гребня (НГ), сохраняющих широкий дифференцировочный потенциал в постнатальном онтогенезе [1]. Применение клеток данного типа в заместительной терапии представляет значительный интерес. В большинстве современных протоколов, для долгосрочного низкотемпературного хранения клеток, в качестве криопротектора используется диметилсульфоксид (ДМСО). Однако токсичность ДМСО варьирует в зависимости от типа клеток, что влечет необходимость подбора концентраций криопротектора и вспомогательных веществ. Целью настоящей работы был подбор оптимальной среды для криоконсервирования диплоидной культуры клеток ДП полученных из вибрисс кроликов, в качестве критерия безопасности изучались патологии митоза и интерфазы.
Материалы и методы. Получение культуры клеток ДП проводили по собственной методике. Одиночные ДП извлекались и помещались в чашки Петри (ЧП (РАА, Австрия)) с желатиновым покрытием. Культивирование производилось в условиях СО2- инкубатора в среде ДМЕМ/F12 с добавлением 10% фетальной телячьей сыворотки (ФТС (Biowest, Франция)). При достижении конфлюэнтного монослоя клетки суспендировали ферментативно. Для получения препаратов митотических клеток, клеточную суспензию высеивали в 6-луночные планшеты, в концентрации 4*104 клеток/см3. Культивирование производили в течение 48 часов, после чего культуры фиксировали и готовили цитологические препараты путем обезвоживания в батарее спиртов и окрашивали Эозином.
Для криоконсервирования клеток использовали растворы ДМСО в концентрациях 5; 7,5; 10; 12,5; 15%. Ряд сред, кроме ДМСО, содержал 5% бычьего сывороточного альбумина (БСА). В качестве контроля использовалась среда ДМЕМ с 10% ДМСО и 5% ФТС. Криоконсервирование осуществлялось с использованием мобильного программного замораживателя ЗПМ -1 в режиме 1 град/мин до – 80 град с дальнейшим погружением в жидкий азот.
Отогрев производился путем быстрого погружения в водяную баню с температурой воды 37 град. После деконсервирования оценивалось количество клеток с поврежденной мембраной путем окрашивания трипановым синим.
Митотическую активность и наличие патологических делений изучали на фиксированных препаратах культур клеток ДП 1 и 2 пассажей с помощью инвертированного микроскопа Leika 2000. Относительное количество клеток с патологией митоза определяли как отношение количества клеток с патологией митоза к общему количеству делящихся клеток, и выражали в процентах.
Для оценки значимости отличий между выборками использовали ANOVA. Отличия считали статистически значимым при p < 0,05.
Результаты и обсуждение. Во всех средах сохранность клеток после отогрева была достаточно высокой – выше 80% (Таблица 1), достоверных отличий по жизнеспособности данным методом обнаружено не было. Наблюдается тенденция к более высокой выживаемости клеток в средах с добавлением БСА и ФТС, по-видимому, высокомолекулярные белковые добавки участвуют в стабилизации структуры клеточной мембраны и уменьшении повреждений, вызванных осмотическим стрессом [3]. Кроме того, белковые компоненты среды снижают негативные эффекты, оказываемые ДМСО на текучесть мембраны и фазовые переходы липидов в ней [7].
Таблица 1.
Сохранность клеток в культурах ДП кролика после криоконсервировавния в различных средах
|
Криозащитная среда |
|||||||||||
|
ДМСО, % |
10; 5% ФТС |
5 |
7,5 |
10 |
12, 5 |
15 |
5 |
7,5 |
10 |
12,5 |
15 |
|
БСА, % |
- |
- |
- |
- |
- |
- |
5 |
5 |
5 |
5 |
5 |
|
живые клетки, % |
96,00± 2,00 |
83,67± 5,51 |
87,33± 2,52 |
89,33± 4,16 |
85,33± 1,53 |
84,67± 3,51 |
93,67± 4,73 |
89,67± 2,52 |
93,00± 2,65 |
94,33± 4,04 |
88,00± 3,00 |
Оказалось, что уровень патологий в культуре после отогрева и 3 суток культивирования возрастал пропорционально используемой концентрации ДМСО (рисунок 1). Значимое возрастание уровня патологий по сравнению с контролем происходило при использовании концентраций ДМСО 12,5 и 15%.
Среди патологий митоза встречались нарушения веретена деления: многополюсный, асимметричный, моноцентрический митоз, трехгрупповая метафаза, полая метафаза, К-митоз, хромосомные мосты и отставание хромосом в анафазе. Среди патологий клеток в интерфазе встречались микроядра, клетки с несколькими ядрами, полиплоиды. Наибольшую долю патологий интерфазы составляли при воздействии высоких концентраций ДМСО (12,5 и 15%), что свидетельствует об их токсичности. Причиной роста числа патологий, связанных с цитоскелетом, может быть влияние ДМСО на полимеризацию микротрубочек, механизм которого состоит в уменьшении эффективной концентрации воды вокруг мономеров тубулина, что способствует образованию центров нуклеации и аномальной полимеризации микротрубочек [4].
При концентрациях ДМСО 12,5 и 15% на 1 и 2 пассаже массово встречались апоптические клетки – с пикнотическими ядрами, аномальной конденсацией хроматина в ядре, формировались апоптические тельца. В литературе имеются данные о способности ДМСО снижать пролиферацию и индуцировать апоптоз в культуре клеток за счет индукции синтеза про-апоптических белков [2, 5, 6].
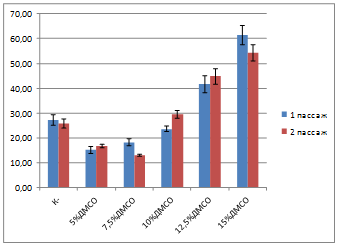
Рисунок 1. Число патологий в культуре клеток, криоконсервированной с добавлением ДМСО,%.
Добавление белковых добавок (ФТС и БСА) не оказывало значимого влияния на уровень патологий (рисунок 2).
На втором пассаже уровень патологий в культурах снижался при использовании криозащитных сред с добавлением 15% ДМСО, что можно считать следствием элиминации клеток, несущих слишком высокий уровень повреждений и преимущественным выживанием менее поврежденных.
Таким образом, токсическое воздействие ДМСО на клетки ДП проявляется в виде повышения числа патологий деления, в то время как целостность клеток при отогреве нарушается менее чем у 20% клеток. Большая же часть клеток, несущих патологии, способны вступать в митоз и претерпевают его с нарушениями [4].
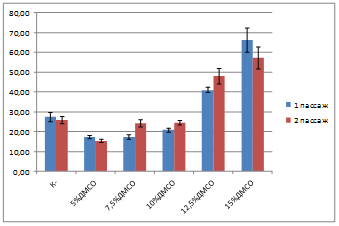
Рисунок 2. Число патологий в культуре клеток, криоконсервированной с добавлением ДМСО и 5% БСА, %.
Процессы апоптоза и митотической катастрофы являются механизмами программируемой гибели клеток, и на уровне клеточной популяции способствуют элиминации поврежденных клеток, что мы и наблюдаем после доконсервирования и в ходе дальнейшего культивирования клеток.


