Новый взгляд на характер каталитического действия ферментов CYР74 (Р450)
Конференция: XXIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Молекулярная биология

XXIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Новый взгляд на характер каталитического действия ферментов CYР74 (Р450)
Аннотация. Показано, что некоторые ранее описанные дивинилэфирсинтазы являются дуалистичными ферментами, что подтверждает их полифилетическое происхождение. Полученные данные расширяют представление о сигнальной системе – липоксигеназном каскаде.
Ключевые слова: цитохромы Р450; ферменты CYP74; липоксигеназный каскад; оксилипины; алленоксидсинтазы; гидропероксидлиазы; дивинилэфирсинтазы; эпоксиалкогольсинтазы; дуалистичные ферменты.
Ферменты CYP74 играют важную роль во многих биохимических реакциях, в том числе в липоксигеназном каскаде, результатом которого является образование оксилипинов [5]. Оксилипины представляют собой биологически активные соединения, участвующие в регуляции процессов роста и развития, и в формировании ответных реакций растений на внешние стимулы [5].
В семейство CYP74 входят алленоксидсинтазы (АОС), гидропероксидлиазы (ГПЛ) и дивинилэфирсинтазы (ДЭС) [2]. Недавно на основании данных филогенетического анализа ряд цитохромов Р450 животных, водорослей и протеобактерий вместе с ферментами CYP74 растений, были объединены в клан CYP74. В состав клана CYP74, помимо вышеперечисленных ферментов, были включены эпоксиалкогольсинтазы (ЭАС) [4]. Ферменты CYP74 не являются типичными цитохромами P450, так как не функционируют как монооксигеназы - действуют в отсутствии любой системы переноса электронов и не активируют молекулярный кислород. Вместо этого ферменты CYP74 катализируют превращение уже насыщенных кислородом гидроперекисей жирных кислот (линолевой и α-линоленовой) [2]. В связи с этим структура ферментов CYP74 имеет ряд особенностей. Например, «кислород-связывающий и активирующий домен» у данных ферментов заменен на гидропероксид-связывающий домен (ГСД) [8]. Данный домен играет важную роль в каталитическом действии ферментов CYP74. Было показано, что замены в данном сайте приводят к смене типа каталитической активности ферментов CYP74 [6], [8], [9].
Кроме того, у ферментов CYP74 в СРС-1 (субстрат-распознающий сайт 1) находится сайт, который носит название F/L toggle, который также принимает участие в каталитическом действии ферментов CYP74 [4]. У алленоксидсинтаз и эпоксиалкогольсинтаз в данном сайте находится фенилаланин, в то время как у гидропероксидлиаз и дивинилэфирсинтаз данный сайт содержит лейцин. Мутации в данном сайте также приводят к смене типа катализа ферментов CYP74 [8].
В 2018 году в нашей лаборатории было показано, что 9/13 ГПЛ подсемейства CYP74C проявляют дополнительную эпоксиалкогольсинтазную активность. [8]. Первоначально было обнаружено, что рекомбинантный фермент CYP74C13_MT люцерны (Medicago truncatula) ведет себя преимущественно как ЭАС по отношению к 9(S)-гидроперекиси линолевой кислоты. В то же время данный фермент проявлял ГПЛ активность по отношению к 13(S)-гидроперекисям линолевой и α-линоленовой кислот. Чтобы проверить, что такое поведение фермента CYP74C13_MT не является случайным, было исследовано еще пять подобных ГПЛ подсемейства CYP74C (CYP74C4_ST (Solanum tuberosum), CYP74C2 (Cucumis melo), CYP74C1_CS и CYP74C31 (Cucumis sativus), CYP74C13_GM (Glycine max)). Все протестированные ферменты вели себя преимущественно как ЭАС по отношению к 9-гидроперекиси линолевой кислоты. Кроме того, фермент CYP74C31 обладал дополнительной алленоксидсинтазной активностью по отношению к данному субстрату. Таким образом, был продемонстрирован дуалистичный характер каталитического действия данных ферментов [8]. Результаты описанной работы позволили по-новому посмотреть на характер каталитического действия ферментов CYP74.
В продуктах реакции АОС томата (CYP74C3) с 9-гидроперекисью были обнаружены в небольшом количестве продукты ГПЛ реакции [8]. У эпоксиалкогольсинтазы плаунка Selaginélla moellendorffii в реакции с 9-гидроперекисью линолевой кислоты синтезировались в минорных количествах α-кетол и 9-оксононановая кислота. Только у ДЭС не было отмечено подобного поведения. Однако механизм каталитического действия ферментов CYP74 является сходным (Рисунок 1). Точкой переключения катализа всех ферментов CYP74 является эпоксиаллильный радикал. Дальше идет превращение субстрата в соответствующий оксилипин [3], [8].
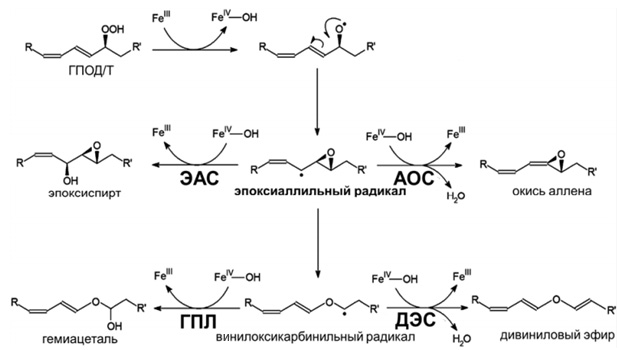
Рисунок 1. Схема каталитических механизмов ферментов CYP74 (по Фатыховой с соавт., 2018)
Объектами данной работы были выбраны три ДЭС из разных подсемейств, а именно – CYP74B, D и Q. Фермент льна-долгунца CYP74B1 (LuDES) утилизирует 13-гидроперекись линоленовой (13-ГПОД) и α-линоленовой кислот (13-ГПОТ). Кроме того, данный фермент активен в отношении 9-гидроперекиси линолевой кислоты (9-ГПОД). Предпочтительным субстратом для фермента льна является 13-ГПОТ. В результате данной работы было показано, что при превращении 13-ГПОД при участии LuDES помимо дивиниловых эфиров образуются эпоксиспирты. По отношению к 9-ГПОД данный фермент проявляет исключительно эпоксиалкогольсинтазную активность. Таким образом, фермент CYP74B1 льна обладает двойной ДЭС/ЭАС активность. Подобными свойствами обладает также ДЭС лютика едкого (CYP74Q1, RaDES). В отличие от предыдущих ферментов ДЭС табака (CYP74D3, NtDES) не утилизирует 13-гидроперекиси жирных кислот. В результате инкубации данного фермента с 9-ГПОД образуется колнелевая кислота – свойственный для 9-специфичных ДЭС продукт. Однако в реакциях с 9-гидроперекисью α-линоленовой кислоты (9-ГПОТ) помимо колнеленовой кислоты (ДЭС продукта) в равном количестве синтезируется 9-оксононановая кислота – продукт ГПЛ. Таким образом, ДЭС табака является 9-специфичным ферментом, обладающим ДЭС/ГПЛ активностью.
В целом, было показано, что некоторые ранее описанные ДЭС являются дуалистичными ферментами. Это может служить подтверждением полифилетического происхождения данных ферментов и повлиять на их распределение на филогенетическом древе ферментов CYP74. Кроме того, полученные данные расширяют представление о важнейшей сигнальной системе – липоксигеназном каскаде.
Получение рекомбинантного фермента LuDES поддержано грантом РФФИ 18-34-01012 мол_а.

