Моделирование первичных процессов фотосинтеза с помощью кинетического метода Монте-Карло
Конференция: XV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Биофизика

XV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Моделирование первичных процессов фотосинтеза с помощью кинетического метода Монте-Карло
Аннотация. Нами была разработана модель элементарных фотосинтетических процессов, происходящих в тилакоидной мембране. Для её верификации мы симулировали кривую индукции флуоресценции хлорофилла a (OJIP) при различных параметрах. В основе модели лежит кинетический метод Монте-Карло, для валидации использовались экспериментальные кривые, полученные после различных воздействий на растения, в том числе после обработки различными видами ингибиторов фотосинтеза, после теплового шока, в анаэробных условиях и при возбуждении светом высокой интенсивности.
Ключевые слова: метод Монте-Карло; фотосинтез; индукция флуоресценции.
Введение. На данный момент в мире широко используются оптические методы для определения фотосинтетической активности растений, водорослей и цианобактерий [16, 2]. Одним из наиболее распространённых является измерение кинетики нарастания флуоресценции хлорофилла (ХЛ). Подробный анализ и интерпретация экспериментально полученных данных может дать важную информацию об особенностях работы фотосинтетического аппарата, включая особенности усвоения энергии, стабилизации возбуждённых состояний, изменения состояний донорной и акцепторной сторон фотосистемы 2 (ФС2), потоков электронов через ФС2 и фотосистему 1 (ФС1), прямых и обратных реакций, гетерогенности ФС2, альтернативных путей электронного транспорта, энергетического взаимодействия реакционных центров и т. п. [11, 15, 8, 5, 12, 1].
Измерение кинетики изменения уровня флуоресценции ХЛ под действием насыщающей вспышки света (OJIP переход), является чувствительным методом, позволяющим судить о состоянии растения при различных видах воздействия на него [6, 13, 14].
Сложную форму полифазной кривой (OJIP) индукции флуоресценции (КИФ) в клетках водорослей или растений ранее связывали с пошаговым восстановлением основного акцептора электронов в ФС2 – семихинона QA. Однако есть и другие факторы, способные повлиять на форму КИФ, такие как редокс изменения феофитина (Фео), QB, пластохинона (ПХ), P680, тирозина Z (Yz), изменение трансмембранного потенциала, конформационные изменения ФС2.
Большинство авторов приходят к согласию, что фотохимическая стадия кривой индукции (фаза OJ) связана с восстановлением акцепторной части большинства ФС2, однако до сих пор не удаётся прийти к единому мнению о природе JIP фазы.
Анализ влияния дибромтимохинона (ДБТХ), ингибитора реокисления ПХH2 цитохромным b6/f комплексом (цит b6/f) и метилвиологена (МВ), акцептора электронов от ФС1, на OJIP кривую показывает, что JI и IP фазы связаны с последовательным восстановлением пула ПХ и редокс компонентов ФС1 [10].
Помимо фаз J, I и P, быстрый компонент K появляется в районе 300-400 мкс при обработке агентами, приводящими к нарушению работы кислород выделяющего комплекса (КВК) ФС2 [17, 18]. Пик K формируется вследствие начального увеличения уровня флуоресценции, связанного с накоплением восстановленного QA с последующим его снижением, связанным с окислением QA- при переносе электрона с QA- на QB в отсутствие поступления новых электронов с КВК. На данный момент нет единого мнения о механизмах, лежащих в основе O(K)JIP переходов в КИФ, что говорит о необходимости дальнейших исследований и поиска способов получения и надёжной интерпретации экспериментальных данных.
Материалы и методы. В последнее время в исследованиях сложных метаболических процессов всё чаще используется метод Монте-Карло [9, 3, 4]. В этом методе используется генерация случайных чисел для имитации случайных событий, происходящих при биохимических окислительно-восстановительных реакциях или при переносе энергии в фотосинтетических процессах.
Происходящие в системе случайные события приводят к изменению редокс состояний отдельных переносчиков, к высвечиванию или поглощению квантов света. Все эти события фиксируются и записываются для дальнейшей обработки.
Для накопления достаточного количества данных об изменении редокс состояний отдельных переносчиков требуется произвести подобную симуляцию для нескольких сотен тысяч элементарных модельных единиц, а для получения КИФ требуется несколько миллионов симуляций [7].
Представленная модельная система (Рисунок 1) представляет собой набор 3-5 млн элементов, каждый из которых представляет собой фотосинтетическую электронтранспортную цепь, состоящую из 1 ФС2, 6 молекул пула ПХ, 1 цит b6/f комплекса, 2 молекул пластоцианина (ПЦ), 1 ФС1 и 6 молекул ферредоксина (ФД).
Наиболее детально в модели представлена структура ФС2, так как она является основным источником флуоресценции. ФС2 представлена антенным комплексом, донорной частью, имеющей в своём составе КВК, Yz и фотоактивный пигмент P680 и акцепторной частью, состоящей из феофитина, первичного хинона QA и сайта QB, который в свою очередь может быть в свободном состоянии либо связанным с молекулой ПХ.
После ФС2 в цепи переноса электрона располагаются пулы ПХ. В данной модели пул был разделён на две части (быструю и медленную) в связи с добавлением в неё Q-цикла. Работа Q-цикла зависит от наличия окисленной или частично восстановленной формы ПХ в области Qi сайта. После полного восстановления ПХ пула на свету, поток электронов через цитохромный b6/f комплекс замедляется ввиду отсутствия окисленной формы ПХ. При наличии только одного быстрого ПХ пула в модели поток электронов через цитохромный b6/f комплекс быстро останавливался, хотя переносчики электрона, находящиеся далее по цепи, оставались частично окисленными.
Важно отметить, что разделение на быстрый и медленный пулы ПХ – это некое упрощение, позволяющее учесть пространственную гетерогенность фотосинтетической мембраны, поскольку экспериментальных доказательств существования быстрого и медленного пулов ПХ не представлено.
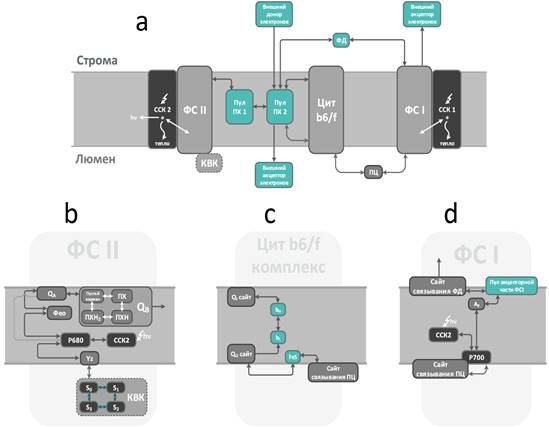
Рисунок 1. Общая схема фотосинтетической электронтранспортной цепи (a) и реакции в ФС2 (b), цитохромном b6/f комплексе (c) и ФС1 (d), учитываемые в модели
Далее в цепи переноса электрона располагается цитохромный b6/f комплекс, представленный в модели двумя сайтами связывания ПХ - Qo и Qi, двумя гемами b типа, железо-серным белком Риске и сайтом связывания ПЦ. Qo сайт связывает и окисляет восстановленный ПХH2, а Qi сайт участвует в Q-цикле. Через него происходит восстановление окисленной формы ПХ в стромальной части мембраны. Помимо сайтов связывания ПХ в Q-цикле также участвуют гемы b-типа. В процессе окисления ПХH2 один электрон поступает на железо-серный белок Риске, а второй электрон, через гемы b-типа переходит в сайт Qi. Железо-серный белок Риске способен восстановить находящийся в сайте связывания ПЦ.
ПЦ является подвижным переносчиком и осуществляет перенос электрона между цит b6/f и ФС1.
ФС1 представлена сайтом связывания ПЦ, хлорофиллом реакционного центра P700, светособирающим комплексом, первичным акцептором A0, пулом электронов акцепторной части, объединяющим в себе A1, Fx, Fa и Fb, и сайтом связывания ФД.
В антенне ФС2 возбуждение деактивируется фотохимически, диссипацией в тепло, либо высвечиванием кванта флуоресценции. Когда P680 оказывается в возбуждённом состоянии, электрон начинает двигаться далее по цепи, восстанавливая Pheo, а затем QA. P680+ восстанавливается тирозином Z (Yz), который в свою очередь получает электрон от КВК.
Последний проходит четыре S состояния и расщепляет молекулу воды (b). В ФС1 возбуждение переходит из антенного комплекса к P700, который восстанавливает первичный акцептор A0. Далее электрон переносится через пул акцепторной части к ФД, находящемуся в сайте связывания ФД (d). P700+ может восстанавливаться электронами, полученными от ПЦ. Дважды протонированная форма QBH2 выходит из сайта связывания и становится ПХH2.
На место неё садится другая молекула ПХ. ПХH2 окисляется цитохромным b6/f комплексом в сайте связывания Qo, но лишь один из двух электронов проходит через железо-серный белок Риске к ПЦ, находящемуся в сайте связывания ПЦ (c). Далее восстановленный ПЦ переносит электрон к ФС1 и восстанавливает P700+ (d). Другой электрон проходит через гемы b-типа и восстанавливает ПХ, находящийся в сайте связывания Qi цитохромного b6/f комплекса (c). ПХ представлен двумя равными частями – пул 1 и пул 2. Пул 1 взаимодействует с ФС2, пул 2 взаимодействует с цит b6/f. Пулы 1 и 2 обмениваются ПХ между собой.
Также пул 2 взаимодействует с ФД, обеспечивая циклический транспорт электронов вокруг ФС1, и с внешними донорами/акцепторами электрона (хлородыхание). Кроме того, восстанавливающая часть ФС1 может окисляться молекулярным кислородом (реакция Меллера).
Измерение экспериментальных кривых. Проростки гороха (Pisum sativum) выращены на жидкой питательной среде. КИФ (OJIP) и кривые изменения отражения модулированного света при 820 нм записывались одновременно с помощью прибора M-PEA2 (Multi-functional Plant Efficiency Analyzer, Hansatech-Instruments, UK). Плотность потока фотонов актиничного cвета cоcтавляла 2500 мкмолей фотонов м–2 c–1. Перед измерениями листья адаптировали к темноте в течение 5 мин.
Результаты. Типичные примеры экспериментальных кривых OJIP и изменения отражения модулированного света при 820 нм представлены на рисунке 2.
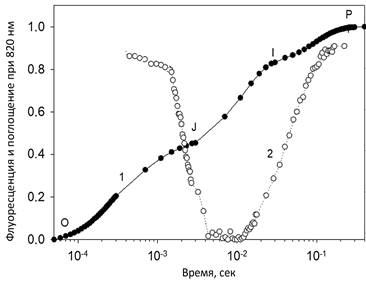
Рисунок 2. Экспериментальная КИФ (OJIP) (кривая 1) и изменение отражения модулированного света при 820 нм (кривая 2), полученные на листьях гороха
Прежде всего на модели были получены КИФ OJIP (рисунок 3, кривая 1). Пики J, I и P на модельной кривой по времени и амплитуде соответствуют экспериментальным данным.
Результаты моделирования воздействия ингибиторов фотосинтеза МВ (рис. 3, кривая 2) и ДБТХ (рисунок 3, кривая 3) также соответствует параметрам аналогичных кривых, полученных экспериментально.
Кинетика накопления QA-, полученная на модели, так же как и OJIP кривая, демонстрирует трёхфазный характер, однако амплитуды соответствующих пиков значительно отличаются. Пик OJ на КИФ имеет амплитуду около 45% от максимального уровня, в то время как этот же пик на кривой накопления QA- достигает почти 90 %.
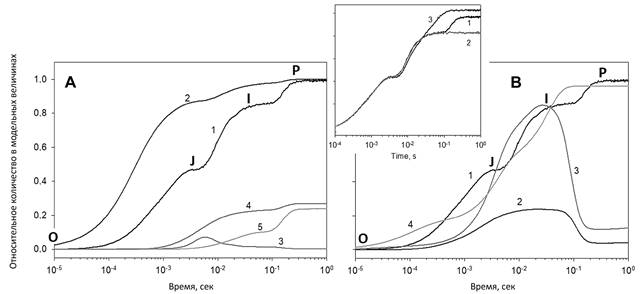
Рисунок 3. Результаты моделирования КИФ OJIP (A и B, кривая 1), накопления QA- (A, кривая 2), P680+ (A, кривая 3), ПХH2, пул 1 (A, кривая 4), ПХH2, пул 2 (A, кривая 5), ПЦ (B, кривая 2), P700+ (B, кривая 3) и ФДвосст. (B, кривая 4). Дополнительный рисунок показывает моделирование изменений, вызванных воздействием метилвиологена (кривая 2) и ДБТХ (кривая 3)
Накопление большей части восстановленного ПХ в пулах 1 и 2 происходило во время фаз JI и IP соответственно. Окисленная форма P680 (P680+) накапливалась в промежутке между 3 и 7 мс от начала освещения.
Изменения редокс состояний переносчиков электрона, расположенных после цитохромного b6/f комплекса изображены на рисунке 3В. Окисление P700 начинается во время фазы OJ и достигает максимума на пике I. Затем в начале фазы IP начинается восстановление P700, которое замедляется, когда небольшая часть P700 ещё остаётся окисленной, что обусловлено реакцией Меллера. Редокс изменения ПЦ схожи с аналогичными изменениями P700.
Как можно было ожидать, степень восстановленности пула ФД достигает максимума незадолго до полного восстановления пула ПЦ.
Обсуждение. Предложенная модель позволяет детально изучить взаимосвязь процессов, происходящих в фотосинтетической электронтранспортной цепи, с изменениями в КИФ, а также других кинетических кривых, которые можно получить экспериментально (например фотоиндуцированное изменение поглощения в области 820 или 705 нм, обусловленное изменением редокс состояния ХЛ реакционного центра ФС1 P700).
Благодаря хорошей детализации, модель позволяет имитировать изменения в электронтранспортной цепи, возникающие при различных условиях (различного рода стрессовые воздействия и действие ингибиторов фотосинтеза).
На данный момент широко распространены кинетические модели фотосинтетических процессов, однако в связи с особенностями построения таких моделей учёт большого количества процессов ведёт к значительному увеличению сложности модели.
К примеру для описания представленной системы понадобилось бы несколько тысяч уравнений.
При этом любые изменения затрагивают значительную часть уравнений и добавление новых переносчиков в модель или изменение существующих процессов становится чрезвычайно трудоёмким.
Представленная модель лишена такого недостатка в связи с тем, что в основе её работы лежит набор правил, каждое из которых зависит только от небольшого окружения или вовсе от других правил не зависит. Поэтому модификация модели и постановка экспериментов при различных начальных условиях требуют минимальных трудозатрат.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-34-00406 мол_а.


