ОСОБЕННОСТИ ВОЗРАСТНОГО НАКОПЛЕНИЯ МИКРОЭЛЕМЕНТОВ МЫШЕЧНОЙ ТКАНЬЮ КЕФАЛИ (CHLEON AURATUS, RISSO, 1810) КАСПИЙСКОГО МОРЯ
Журнал: Научный журнал «Студенческий форум» выпуск №41(350)
Рубрика: Биология

Научный журнал «Студенческий форум» выпуск №41(350)
ОСОБЕННОСТИ ВОЗРАСТНОГО НАКОПЛЕНИЯ МИКРОЭЛЕМЕНТОВ МЫШЕЧНОЙ ТКАНЬЮ КЕФАЛИ (CHLEON AURATUS, RISSO, 1810) КАСПИЙСКОГО МОРЯ
Аннотация. Работа посвящена изучению изменений концентрации микроэлементов в мышечной ткани каспийской кефали. Исследование базируется на ихтиологических данных, полученных в период с 2019 по 2020 годы в центральной акватории Каспия.
Abstract. This study examines changes in trace element concentrations in the muscle tissue of Caspian mullet. The research is based on ichthyological data obtained between 2019 and 2020 in the central Caspian Sea.
Ключевые слова: Каспийское море, кефаль, мышечная ткань, микроэлементы.
Keywords: Caspian Sea, mullet, muscle tissue, trace elements.
Детрит имеет существенное трофическое значение для многих видов рыб. Так, детрит входит в состав кормовой базы таких видов, как карась
(Carassius сarassius), лобан (Migul cephalus ), сингиль (Liza aurata ), остронос (L. saliens), пиленгас (L. haematocheilus ) и многие другие. Детрит является пищевым компонентом многих видов планктонных организмов простейших, коловраток, ракообразных, в том числе – фильтраторов. Детрит формируется за счет прижизненных и посмертных продуктов жизнедеятельности водных организмов, минеральных частиц с адсорби-рованными на них бактериями, «хлопьев» растворенного органического вещества (РОВ) и др. Часть детрита образуется в эпилимнионе, где концентри-
руются водоросли, бактерии, зоопланктон, часть – в поверхностной пленке водоема [5; 6; 7; 28 ] Каспий – является крупнейшим на планете внутренним водоем, не имеющий выхода к океану, и является замкнутым водоёмом. Однако, из-за своих внушительных размеров и повышенного содержания соли в воде, этот водный резервуар исторически именуется морем. Несмотря на это, он не обладает всеми характеристиками, присущими морям, в частности, отсутствием прямого природного соединения с мировым океаном. Детрит играет существенную роль в экосистеме Каспия. Его образование обусловлено биологической активностью морских организмов, наличием минеральных частиц с осевшими бактериями, взвешенными органическими соединениями и речным притоком. [7]. По мере оседания детрита происходит его минерализация, также детрит проявляет высокую сорбционную способность. Он может адсорбировать на своей поверхности и иммобилизовывать органические и неорганические вещества воды, бактерий, а также присутствующие в среде ферменты [14].
Впоследствии активного поступления речных вод, геологоразведочных работ и добычи нефти и газа, экосистема Каспия испытывает значительное давление, что приводит к усилению антропогенного влияния на водных обитателей. В результате негативного воздействия окружающей среды у рыб наблюдаются нарушения в функционировании различных органов и систем [10]. Выявление патологических изменений имеет ключевое значение для выяснения факторов, определяющих динамику численности кефали, и для ее прогнозирования. Экосистема Каспийского моря подвержена интенсивной нагрузки за счет активного речного стока, нефтеразведке и добыче углеводородов, поэтому возрастает антропогенное влияние на гидробионтов. В ответ на негативное воздействие среды у рыб возникают нарушения функционирования различных систем организма [10]. Идентификация патологических изменений важна для понимания причин колебания численности кефали и её прогнозирования. В связи с этим, научные работы посвященные исследованию современного состояния популяции кефали в российской части каспийского моря являются важными и актуальными. Таким образом, научные исследования, направленные на изучение текущего состояния популяции кефали в Каспийском море, представляют собой важную и актуальную задачу.
Материалы и методы. В период с 2019 по 2020 годы, весной, в центральной части Каспийского моря осуществлялся отлов и исследование ихтиофауны. В полученных уловах был идентифицирован единственный представитель – сингиль (Liza aurata, Risso, 1810). Изучение биологических параметров сингиля проводилось согласно стандартной методологии, предложенной И.Ф. Правдиным [11]. В ходе биологического анализа кефали определяли такие показатели, как промысловая длина, вес, половая принадлежность и степень зрелости гонад. Всего было проанализировано 180 экземпляров сингиля.
Исследование содержания химических элементов в мускулатуре кефали было проведено на кафедре "Гидробиологии и общей экологии" ФГБОУ ВО «Астраханского государственного технического университета». Количественное определение концентраций железа, хрома, меди, свинца, никеля, кобальта, кадмия, марганца и цинка осуществлялось с использованием метода атомно-абсорбционной спектрометрии, согласно требованиям ГОСТ 30178-96 [1]. В ходе анализа применялся атомно-абсорбционный спектрофотометр Hitachi 180-50. Для статистической обработки полученных данных использовалась программа Microsoft Office Excel версии 2019. (Liza aurata, Risso, 1810).
Результаты и их обсуждение. Исследования учёных Куликова [8], Пробатовой [12] и Хорошко [17], свидетельствует о том, что каспийский сингиль демонстрирует более интенсивный рост по сравнению с черноморским. Полученные нами результаты, касающиеся линейно-весовых характеристик сингиля, подтверждают эти наблюдения (таблица 1). В целях сопоставления, представленные в нашей таблице данные агрегируют средние показатели, полученные для самцов и самок.
Таблица 1.
Данные роста сингиля (Liza aurata, Risso, 1810) в Каспийском и Черном морях
|
Возрастная группа, годы |
Каспийское море (средняя часть (2019 – 2020 гг., наши данные) |
Каспийское море (туркменское побережье) [17] |
Чёрное море (северо-восточная часть) [16] |
||
|
абсолютная длина (см) |
Масса (кг) |
абсолютная длина (см) |
Масса (кг) |
абсолютная длина (см) |
|
|
2 |
26 |
0,280 |
20,8 |
0,225 |
15,7 |
|
3 |
32 |
0,460 |
28,1 |
0,510 |
19,7 |
|
4 |
34 |
0,489 |
32,9 |
0,661 |
23,4 |
|
5 |
36 |
0,678 |
36,3 |
0,912 |
26,4 |
|
6 |
38 |
0,740 |
40,1 |
1,147 |
29,4 |
|
7 |
39 |
0,883 |
43,1 |
1,315 |
32,9 |
|
8 |
40 |
0,960 |
45,5 |
1,613 |
36,1 |
|
9 |
44 |
1,050 |
47,1 |
2,080 |
39,3 |
|
10 |
45 |
1,130 |
50,5 |
- |
41,2 |
Возрастная структура рыб была изучена посредством биологического анализа, охватывающего девять возрастных групп (от 2 до 10 лет). Средний возраст исследованных особей оценивался в 5,9 лет. Наиболее многочисленными в выборке оказались рыбы в возрасте четырех и пяти лет. Биологическая характеристика исследуемых особей кефали в Каспийском море представлена в таблице 2.
Таблица 2.
Биологическая характеристика сингиля (Liza aurata, Risso, 1810) в Каспийском море 2019 – 2020 гг.
|
Самки |
Самцы |
||||||
|
коли-чество |
Абсолютная длина (см) |
Масса (кг) |
Возрастная группа |
коли-чество |
Абсолютная длина (см) |
Масса (кг) |
Возрастная группа |
|
12 |
26 ± 0,7 |
0,280 ± 0,09 |
2 |
9 |
23 ± 0,9 |
0,201 ± 0,02 |
2 |
|
16 |
32 ± 1,0 |
0,460 ± 0,20 |
3 |
7 |
30 ± 0,7 |
0,341 ± 0,01 |
3 |
|
24 |
34 ± 0,8 |
0,489 ± 0,12 |
4 |
12 |
31 ± 1,1 |
0,478 ± 0,12 |
4 |
|
29 |
36 ± 1,3 |
0,678 ± 0,09 |
5 |
11 |
34 ± 1,8 |
0,544 ± 0,13 |
5 |
|
|
- |
- |
6 |
8 |
36 ± 1,2 |
0,615 ± 0,08 |
6 |
|
15 |
39 ± 1,4 |
0,740 ± 0,19 |
7 |
3 |
38 ± 1,0 |
0,801 ± 0,18 |
7 |
|
10 |
40 ± 1,7 |
0,965 ± 0,01 |
8 |
7 |
39 ± 1,5 |
0,926 ± 0,15 |
8 |
|
9 |
44 ± 1,3 |
1,050 ± 0,13 |
9 |
5 |
40 ± 1,2 |
0,981 ± 0,19 |
9 |
|
3 |
45 ± 0,9 |
1,130 ± 0,15 |
10 |
|
- |
- |
10 |
Поступление микроэлементов в тело рыб обусловлено геохимическими особенностями окружающей среды и служит показателем уровня воздействия человека на экосистему [10]. Скорость накопления этих веществ соответствует скорости обменных процессов, которая, в свою очередь, определяется возрастом и массой тела. Благодаря механизмам поддержания внутреннего равновесия [2], рыбы могут контролировать концентрацию элементов в своих органах и тканях. Микроэлементы, будучи биологически значимыми соединениями, по-разному воздействуют на животных в неблагоприятных условиях. Повышенная концентрация тяжелых металлов в организме негативно сказывается на его общем функционировании.
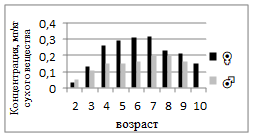
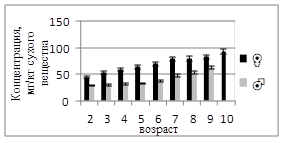
Содержание хрома в мышцах самок варьировало в пределах 0,03–0,32 мг/кг, тогда как у самцов — 0,06–0,70 мг/кг (рис.1). У самок наблюдается плавный рост концентрации Cr до 7-летнего возраста, после чего происходит снижение. У самцов на ранних стадиях (2 года) отмечено аномально высокое значение (0,70 мг/кг), что может быть связано с индивидуальными колебаниями обмена или локальной техногенной нагрузкой. В целом самцы характеризуются несколько более высоким содержанием хрома, что, вероятно, связано с более активным метаболизмом и скоростью роста тканей. У самок концентрация Fe постепенно возрастает от 44,63 до 93,13 мг/кг, демонстрируя чёткую возрастную тенденцию к накоплению. У самцов содержание железа существенно ниже — 28,86–62,13 мг/кг, однако также имеет выраженный ростовой тренд (рис.2). Таким образом, мышцы самок характеризуются более высоким содержанием Fe, что можно объяснить физиологической потребностью в железе для обеспечения процессов кроветворения и репродуктивных функций. С возрастом у обеих полов отмечается тенденция к аккумуляции элемента, отражающая возрастные изменения обмена веществ.
|
Рисунок 1. Среднее содержание хрома в мышечной ткани самок и самцов сингиля по возрасту |
Рисунок 2. Среднее содержание железа в мышечной ткани самок и самцов сингиля по возрасту |
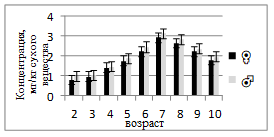
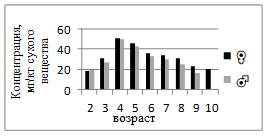
Содержание меди в мышцах самок увеличивается с возрастом от 0,79 до 2,91 мг/кг, достигая максимума в 7-летнем возрасте, после чего слегка снижается (рис. 3). У самцов диапазон колебаний составляет 0,98–3,10 мг/кг, пик также приходится на 7 лет. Это указывает на сходные закономерности накопления элемента, связанного с ферментативной активностью и антиоксидантной защитой организма. Медь, как кофактор окислительно-восстановительных ферментов, активнее накапливается в мышечной ткани в период интенсивного роста. У самок концентрация Zn варьирует от 18,3 до 50,36 мг/кг, достигая максимума в 4 года, а затем постепенно снижается к старшим возрастам (до 20,05 мг/кг). У самцов Zn изменяется в пределах 15,33–61,39 мг/кг, также демонстрируя пик в 4-летнем возрасте (рис.4). Цинк активно участвует в метаболизме белков и нуклеиновых кислот, поэтому его повышенное содержание характерно для периода активного роста. Снижение у старших особей связано со стабилизацией метаболических процессов и возможным перераспределением элемента в другие органы.
|
Рисунок 3. Среднее содержание меди в мышечной ткани самок и самцов сингиля по возрасту |
Рисунок 4. Среднее содержание цинка в мышечной ткани самок и самцов сингиля по возрасту |
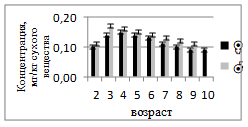
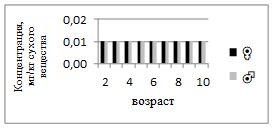
Концентрация никеля у самок колеблется в пределах 0,10–0,20 мг/кг, а у самцов — 0,10–0,17 мг/кг (рис.5). Существенных различий между полами не выявлено. Возрастная динамика выражена слабо, что говорит о стабильном содержании элемента, обусловленном естественными биохимическими процессами. Накопление никеля может быть связано с его участием в функционировании ферментов у рыб. Кобальт присутствует в крайне малых количествах (0,01–0,02 мг/кг) у обеих полов (рис.6). Существенной возрастной или половой зависимости не наблюдается. Это типично, поскольку кобальт в организме рыб необходим в микроколичествах — как компонент витамина B₁₂ и метаболических ферментов.
|
Рисунок 5. Среднее содержание никеля в мышечной ткани самок и самцов сингиля по возрасту |
Рисунок 6. Среднее содержание кобальта в мышечной ткани самок и самцов сингиля по возрасту |
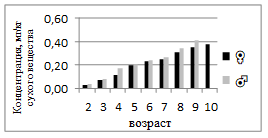
У самок содержание Cd постепенно увеличивается от 0,03 до 0,31 мг/кг, достигая максимума в 8-летнем возрасте. У самцов значения сходного диапазона — 0,04–0,41 мг/кг (рис. 7). С возрастом наблюдается тенденция к накоплению, что объясняется кумулятивным характером кадмия и его низкой скоростью выведения. Более высокие значения у старших особей указывают на постепенное загрязнение водной среды тяжелыми металлами.
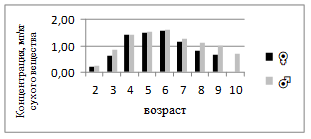
Концентрация Pb у самок изменяется в пределах 0,20–1,49 мг/кг, а у самцов — 0,23–1,40 мг/кг (рис.8). Пик содержания свинца отмечается в 4–7 лет, что, вероятно, отражает повышенную техногенную нагрузку в прибрежных зонах. У старших особей наблюдается тенденция к снижению, что может быть связано с адаптационными механизмами и перераспределением элемента в печень.
|
Рисунок 7. Среднее содержание кадмия в мышечной ткани самок и самцов сингиля по возрасту |
Рисунок 8. Среднее содержание свинца в мышечной ткани самок и самцов сингиля по возрасту |
Содержание марганца у самок составляет 0,02–0,55 мг/кг, а у самцов — 0,09–0,54 мг/кг (рис.9). В целом Mn демонстрирует слабую возрастную динамику, с небольшим повышением в среднем возрасте (4–7 лет). Марганец участвует в формировании костной ткани и ферментативных процессах, поэтому его колебания могут быть связаны с физиологическими изменениями роста.
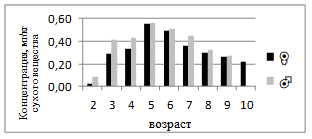
Рисунок 9. Среднее содержание марганца в мышечной ткани самок и самцов сингиля по возрасту
Выводы.
1. Мышцы самок в целом содержат большее количество Fe, Zn и Cu, чем у самцов, что отражает более активные обменные процессы, связанные с репродуктивной функцией
2. У самцов отмечается несколько более высокое содержание Cr и Cd, что может быть следствием различий в питании или воздействии внешней среды.
3. Для большинства микроэлементов (Fe, Cu, Cd, Pb) наблюдается возрастная тенденция к накоплению, характерная для биомониторинговых объектов.
4. Полученные данные подтверждают, что мышцы кефали являются индикатором состояния экосистемы Каспийского моря, отражая степень антропогенной нагрузки по тяжёлым металлам.

