ИЗУЧЕНИЕ ДИНАМИКИ РОСТА И БИОЛОГИЧЕСКИХ СВОЙСТВ БАКТЕРИИ Bacillus sp. F, ВЫДЕЛЕННОЙ ИЗ ВЕЧНОЙ МЕРЗЛОТЫ
Секция: Биология

L Студенческая международная научно-практическая конференция «Естественные и медицинские науки. Студенческий научный форум»
ИЗУЧЕНИЕ ДИНАМИКИ РОСТА И БИОЛОГИЧЕСКИХ СВОЙСТВ БАКТЕРИИ Bacillus sp. F, ВЫДЕЛЕННОЙ ИЗ ВЕЧНОЙ МЕРЗЛОТЫ
В последнее время возрос интерес к микробиологическим препаратам для повышения продуктивности, а также устойчивости растений к бактериальным и грибным фитопатогенам. Одним из путей решения этой задачи является разработка методов защиты растений от фитопатогенов с помощью их колонизации ассоциативными микроорганизмами, которые устанавливают с растениями прочную симбиотическую связь. Ассоциативные микроорганизмы оказывают стимулирующее влияние на рост и урожай растений за счет способности к азотфиксации, образования физиологически активных веществ, мобилизации питательных элементов из почвы [1]. Расширение спектра полезных ассоциативных микроорганизмов является важной задачей современной биотехнологии.
Бактерия Bacillus sp.F выделена из вечномерзлых песков Мамонтовой горы (Центральная Якутия) более 10 лет назад [2]. Показано, что эти бактерии являются факультативными анаэробами, представляют собой грамположительные спорообразующие палочки, предпочитают температуру культивирования 370С. Штамм Bacillus sp.F является близкородственным к B. cereus, B. simplex, B. macroides, гомология с 16S rRNA которых составляет 96-97%. Полное секвенирование генома позволило определить, что Bacillus sp. F обладает высоким уровнем гомологии с некоторыми штаммами Bacillus cereus [2].
Целью нашей работы являлось исследование физиолого-биологических характеристик бактерии Bacillus sp. F, таких как скорость роста, антибиотические и антифунгальные свойства, способность к ассоциации с растениями.
Бактериальную культуру Bacillus sp. F выращивали в жидкой среде Лурия-Бертани (LB) на орбитальном шейкере (ИБП РАН) при 370С, 130 об/мин. Вначале вносили 1мл ночной культуры с титром 1х1011 колониеобразующих единиц (КОЕ)/мл в 100 мл жидкой среды LB. Оптическую плотность культуры определяли при 600 нм на спектрофотометре Specol 221 (рис. 1).
Динамику роста культуры определяли с помощью подсчета колоний. В определенные промежутки времени отбирали пробы, разводили в 106 раз жидкой средой LB, шпателем втирали по 100 и 200 мкл разведенной культуры в чашки Петри с рыбно-пептонной агаризованной средой (РПА). Определяли КОЕ в 1 мл культуры бактерий по формуле: (число колоний, выросших после разведения х коэффициент разведения)/объем разведенной суспензии для посева. Параллельно для некоторых точек роста было определено количество клеток в культуральной жидкости на цитофлуориметре NovoCyte (Agilent, США). Судя по динамике роста бактерий, рост клеток прекращался через 24-30 часов после начала культивирования (рис. 2).
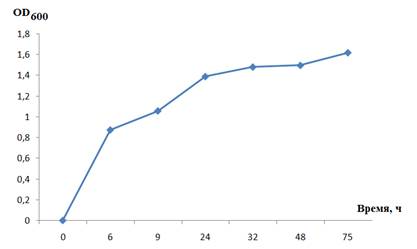
Рисунок 1. Динамика изменения оптической плотности Bacillus sp. F при периодическом культивировании
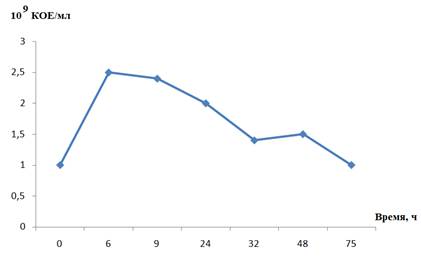
Рисунок 2. Динамика роста бактерий Bacillus sp. F при периодическом культивировании
Таким образом, анализ роста исследуемых бактерий показал, что оптимальным сроком культивирования штамма Bacillus sp. F является 24 часа, поскольку в этот период компоненты питательной среды активно потреблялись и полностью использовались бактериями. Рост культуры замедлялся после максимального накопления биомассы (6 часов) в конце экспоненциальной фазы, затем наблюдалось снижение роста бактерий (рис. 1, 2).
Эксперименты по колонизации растений проводили следующим образом. Молодые побеги табака в культуре in vitro обрабатывали суспензией бактерий с титром 103–104 КОЕ/мл и культивировали в пробирках на безгормональной агаризованной среде Мурасиге-Скуга (МС) при температуре 22-240С, 16-часовом световом дне и освещенности 2.5 клк. Проростки размножали черенкованием раз в месяц. Показана стимуляция роста колонизированных растений (рис. 3).

1 2 3 4
Рисунок 3. Стимуляция роста колонизированных бактериями Bacillus sp. F побегов табака. 1, 2 – неколонизированные растения (контроль); 3,4 – растения, колонизированные Bacillus sp.F.
Тестирование эксплантов (листьев или корней) на наличие ассоциированных бактерий проводили через 7 и 14 суток после колонизации. С этой целью растительный экстракт, полученный путем гомогенизации 1 г растительной ткани, наносили на поверхность твердой питательной среды РПА в чашках Петри и инкубировали при температуре 370С в течение 2 сут, затем проводили подсчет колониеобразующих единиц (КОЕ). Через 7 и 14 сут после колонизации табака бактериями их численность на корнях увеличивалась с 2.2 х 103 (7 сут) до 2.3 х 104 (14 сут) КОЕ/г сырой массы. В последующих циклах микроразмножения растений содержание бактерий в корнях сохранялось практически на одном уровне, что указывает на их прочную ассоциацию с растениями.
Определение антибактериальной активности бактерий Bacillus sp. F проводили с использованием метода радиальной диффузии [3]. Ночную культуру бактерий центрифугировали и полученный супернатант вносили в лунки, сделанные в агаре, на поверхность которого были нанесены патогенные бактерии. Чашки Петри выдерживали 5 часов при 40С для диффузии внесенной жидкости в агар, а затем переносили в термостат на 280С. В качестве патогенных микроорганизмов использовали бактерии Rhodococcus equi BKМ АС-953, вызывающие заболевания верхних дыхательных путей у животных, а также у человека при ослабленном иммунитете (рис. 4А). С целью определения антифунгальной активности бактерий Bacillus sp. F, на одной чашке Петри со средой РПА одновременно выращивали бактерию и гриб Gaeumannomyces graminis var. tritici Ggt1818, вызывающий гнили корней и основания листьев у растений. Ограничение роста гриба по отношению к бактериям свидетельствовало о наличии антифунгальных веществ, выделяемых бактериями (рис. 4Б).

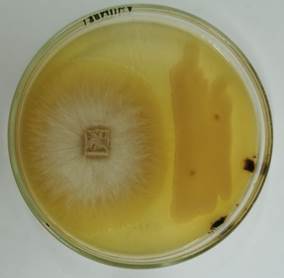
А Б
Рисунок 4. Проявление антагонизма бактериями Bacillus sp. F. А – антибиотическая активность культуральной жидкости Bacillus sp. F по отношению к бактериям Rhodococcus equi BKМ АС-953 (видна прозрачная зона лизиса вокруг лунок); Б – антифунгальная активность бактерии Bacillus sp. F (справа) по отношению к грибу Gaeumannomyces graminis var. tritici Ggt1818 (слева).
Таким образом, нами исследованы биологические свойства бактерии Bacillus sp. F. Определена динамика роста бактерий при периодическом культивировании. Впервые показана возможность образования прочных ассоциаций с растениями, что улучшило рост растений. Установлены штаммы патогенных для человека и растений бактерий и грибов, рост которых подавлялся с помощью Bacillus sp. F. Полученные результаты указывают на возможность использования этих бактерий для защиты растений от фитопатогенов, а также в ветеринарии и медицине в качестве пробиотика.





