Аминокислотный анализ лекарственного растительного сырья на примере Chelidonii herbae
Секция: Медицина и фармацевтика

XLIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Аминокислотный анализ лекарственного растительного сырья на примере Chelidonii herbae
Введение
Возможность длительного безопасного применения препаратов растительного происхождения благодаря мягкому терапевтическому действию, минимизации противопоказаний наряду с высокой эффективностью, оправдывает их широкое использование при лечении различных заболеваний [2, с. 367]. Применение водных извлечений лекарственного растительного сырья (ЛРС) имеет преимущество в том, что они обеспечивают хорошую доступность лекарственных веществ, и их приготовление не требует применения специальной аппаратуры [1, с. 117]. По сравнению с индивидуальными лекарственными средствами они вызывают более мягкое действие на организм, лучше переносятся, имеют низкий уровень проявления побочного эффекта, могут применяться длительно [7, с. 82].
Одной из актуальных задач современной фармацевтической науки является поиск отечественных растительных сырьевых источников биологически активных веществ для создания на их основе препаратов различной фармакологической направленности [7, с. 83]. По данным литературы, ЛРС имеет достаточно сложный химический состав и многообразие биологически активных соединений, что позволяет определить их широкое применение в медицине [4, с. 228]. Однако аминокислотный состав ЛРС достаточно глубоко не изучен. Исходя из вышесказанного, актуальной задачей является аминокислотный анализ водных извлечений ЛРС [2, с. 226].
Нами была проанализирована Chelidonii herbaee, поскольку этот фитопрепарат обладает рядом фармакологических свойств: анальгезирующее, иммуносупрессивное, спазмолитическое, противовоспалительное и др., а также очень широко применяется как в народной, так и в традиционной медицине [1, с. 366]. Состав Chelidonii herbaee, в основном представлен алкалоидами, флавоноидами, органическими кислотами и другими соединениями [5, c. 392]. Информация об аминокислотном составе водных извлечений Chelidonii herbaee не представлена широко, что послужило целью нашего исследования.
Целью данного исследования явилось изучить возможность аминокислотного анализа водных извлечений Chelidonii herbae методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Материалы и методы исследования
Объектом исследования служат свободные аминокислоты в водных извлечениях (настоях) Chelidonii herbaee. Пробоподготовка водных извлечений проводилась согласно Государственной Фармакопее Республики Беларусь в инфундирном аппарате с соблюдением температурного и временного режимов. Анализ аминокислот проводился с использованием техники обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ).
Из образцов стандартизированного суховоздушного сырья Chelidonii herbae готовили настой с использованием инфундирного аппарата. Среди факторов, влияющих на динамику извлечения действующих веществ учитывали степень измельченности сырья (было использовано стандартизированное сырье, применяемое в домашних условиях), режим перемешивания, соотношение сырья и реагента (для обеспечения полноты извлечения действующих веществ соотношение сырья и воды составило 1:400), степень водопоглощения (так как данных не было, проводилось экспериментально), продолжительность нагревания и охлаждения (15 и 50 минут соответственно), значение рН среды (так как необходима депротеинизация белковых комплексов, добавляли раствор хлорной кислоты).
Анализ аминокислот проводился с использованием техники обращенно-фазовой ВЭЖХ.
Непосредственно перед процессом преобразования аминокислот полученный супернатант фильтровали через фильтр PVDF 0,2 μm (Whatman, Германия).
Условиями хроматографирования были следующие. Использовался хроматограф Aligent 1100 HP, хроматографическая колонка AA-ODS Hypersil, размеры колонки: 2,1x200 mm, размер зерна: 5 μm. Колонка содержит протестированный сорбент с обращенной фазой. Скорость потока 0,45 мл/мин.
В качестве подвижных фаз использовались А-фаза и В-фаза. Состав А-фазы: 0,018% ацетатный буфер с концентрацией 20 mM; триэтиламин, доведенный до рН 7,2 с добавлением 1-2% уксусной кислоты. Состав В-фазы: 20% ацетата натрия с концентрацией 100 mM, доведенного до рН 7,2 раствором 1–2% уксусной кислоты + 40% ацетонитрила + 40% метанола [1;2].
Анализ полученных результатов
Для регистрации первичных аминокислот, их необходимо подвергнуть реакции с ортофталевым альдегидом (ОФА).
Установлено, что при образовании дериватов, ее адсорбционный спектр изменяется и регистрируется дополнительная полоса поглощения с максимумом при длине волны 338 нм.
Образование ОФА-дериватизированных аминокислот осуществляется по механизму нуклеофильного присоединения и проводится в щелочной среде, т.к. в этой реакции аминогруппа аминокислоты выступает в роли нуклеофила и должна находиться в депротонированной форме.

Рисунок 1. Взаимодействие ортофталевого альдегида с меркаптоэтанолом
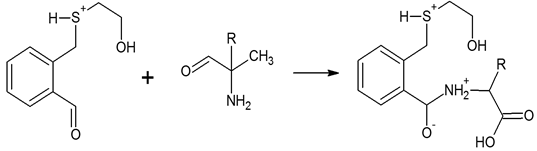
Рисунок 2. Взаимодействие продукта первой реакции с аминокислотой
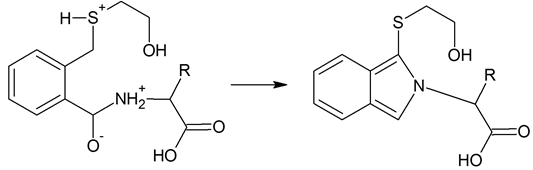
Рисунок 3. Образование дериватизированной аминокислоты
В результате была получена хроматограмма с хроматографическими пиками, соответствующими зонам выхода аминокислот или их производным. Идентификация соединений проводилась программой Chemstation 09.03 путем сравнения зон выхода аминокислот с калибровочной кривой смеси аминокислот. Так, аспарагиновая и глутаминовая кислоты имели время удерживания 2–3 минуты, а аргинин и аланин – 7–8 минут.
Заключение
В ходе выполнения работы были получены следующие результаты:
1. Исследованы оптимальные условия пробоподготовки водных извлечений Chelidonii herbae с депротеинизацией белковых соединений 0,1М HClO4.
2. Установлена возможность применения методики обращенно-фазовой хроматографии для анализа свободных аминокислот (глутаминовой, аспарагиновой, аргинина и аланина) по реакции с ортофталевым альдегидом.





