Валидация методики идентификации таблеток "Rinomax" методом ВЭЖХ
Секция: Медицина и фармацевтика

XLIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Валидация методики идентификации таблеток "Rinomax" методом ВЭЖХ
Проведена валидация методики идентификации таблеток “Rinomax” методом высокоэффективной жидкостной хроматографии (ВЭЖХ) по параметру специфичность.
Согласно требованиям Европейской фармакопеи все методики контроля качества лекарственных средств, которые используются в фармакопейных статьях, должны быть валидированы. Особенно если с помощью валидации решается такая задача как очистка оборудования при производстве лекарственного средства (ЛС). Учитывая, что таблетки Rinomax имеют многокомпонентный состав (парацетамол, кофеин, фенилэфрин гидрохлорид, хлорфенирамина малеат) необходимо оценить каждое из анализируемых веществ в присутствии других компонентов через определение типичной валидационной характеристики как специфичность. Для идентификации ингредиентов “Rinomax” в таблетках использована методика ВЭЖХ, приведенная в ФС 42 Уз-7238-2011.
Любая аналитическая методика в контроле качества лекарственных веществ, которая предполагается для внесения в какой-либо нормативный документ должна быть валидирована.
Поскольку в фармацевтическом анализе наибольший интерес представляет проведение валидации для следующих показателей:
· идентификация;
·количественные испытания определения примесей;
· испытания на предельное содержание контроля примесей;
· количественные определения действующих веществ в образцах активного фармацевтического ингредиента (АФИ) или готовой фармацевтической продукции, а также других компонентов лекарственного препарата (ЛП) существуют испытания, предназначенные для решения этих задач.
В таблице 1 представлен набор валидационных параметров в зависимости от типа аналитической методики.
Таблица 1.
Необходимый набор валидационных характеристик в зависимости от типа аналитической методики
|
Характеристики |
Типы аналитических методик |
|||
|
идентификация |
Испытания на примеси
количест- предель- венные ные |
Количественное определение: -растворение (только определение), -содержание/активность |
||
|
Правильность |
- |
+ |
- |
+ |
|
Прецизионность: Сходимость Внутрилабораторная прецизионность |
-
- |
+
+ * |
-
- |
+
+ * |
|
Специфичность** |
+ |
+ |
+ |
+ |
|
Предел обнаружения |
- |
- *** |
+ |
- |
|
Предел количественного определения |
- |
+ |
-
|
- |
|
Линейность |
- |
+ |
- |
+ |
|
Диапазон применения |
- |
+ |
- |
+ |
«-» – характеристика обычно не исследуется
«+» – характеристика обычно исследуется
* – в тех случаях, когда проводится исследование воспроизводимости, исследование внутрилабораторной прецизионности не требуется
** – недостаток специфичности испытания можно компенсировать другим (другими) дополнительным(и) испытанием(ями)
*** – может потребоваться в некоторых случаях (например, когда предел определения и нормируемый предел содержания определяемой примеси близки)
Экспериментальная часть
В качестве объекта исследования использовали “Rinomax” (ДХО NikaPharm) содержащий такие ингредиенты как парацетамол, кофеин, фенилэфрин гидрохлорид, хлорфенирамина малеат и вспомогательные вещества: карбоксиметилкрахмал натрия, повидон, пропиленгликоль, крахмал кукурузный, метилпарабен, пропилпарабен, тальк, целлюлоза, магния стеарат. В соответствии с ФС 42 Уз-7238-2011 для данного ЛП предложена методика ВЭЖХ. При проведении исследований использовали субстанции, отвечающим требованиям BP, USP, используемые реактивы и растворы требованиям ГФ XI издания.
Исследования проводили на жидкостном хроматографе марки Agilent Technologies Инфинити 1260, аналитические весы AS-220Х 334407/11. Для работы использовали посуду класса А.
Время удерживания основного пика парацетамола, кофеина, фенилэфрина гидрохлорида, хлорфенирамина малеата на хроматограмме испытуемого раствора препарата должно соответствовать времени удерживания пика на хроматограмме стандартного раствора каждого из активных веществ.
Методика. Около 307,5 мг (точная навеска) порошка растертых таблеток помещают в мерную колбу вместимостью 50 мл, прибавляют 30 мл подвижной фазы и обрабатывают с помощью ультразвука в течение 10 мин, доводят объем раствора подвижной фазы до метки и перемешивают и фильтруют (испытуемый раствор 1 для определения кофеина, фенилэфрина гидрохлорида, хлорфенирамина малеата).
5 мл полученного фильтрата помещают в мерную колбу вместимостью 50 мл, доводят объем раствора подвижной фазой до метки и перемешивают (испытуемый раствор 2 для определения парацетамола).
Вводят трижды по 20 мкл смешанного стандартного раствора, 20 мкл стандартного раствора для определения хлорфенирамина малеата и по 20 мкл испытуемых растворов 1 и 2 в хроматограф, регистрируют хроматограммы и измеряют отклики основных пиков.
При хроматографических исследованиях специфичность определяется степенью разделения пиков заданных ингредиентов. Относительная ошибка погрешности (δ, %), вносимая другими ингредиентами в определении анализируемого вещества, вычисляется по формуле:
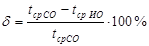
и составляет не более 2%.
Для раствора испытуемого образца (ИО) и стандартных образцов (СО) записывают по три хроматограммы, определяют времена удерживания основных пиков парацетамола, кофеина, фенилэфрина гидрохлорида, хлорфенирамина малеата. Для раствора ИО парацетамола, кофеина, фенилэфрина гидрохлорида, хлорфенирамина малеата и для растворов СО вычисляют среднее значение времени удерживания соответственно tср ИО и tср СО, минимальную и относительную систематическую ошибку (δ, %) значения модельного препарата к значению СО.
Результаты представлены в таблице 2.
Таблица 2.
Определение относительной ошибки погрешности
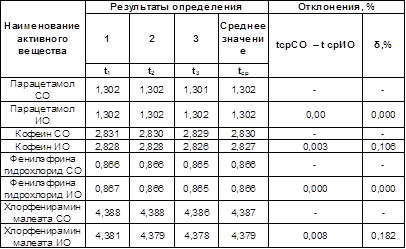
Данные таблицы указывают, что фоновые погрешности в некоторых случаях отсутствуют (парацетамол, фенилэфрина гидрохлорид), а в случае кофеина и хлорфенирамина являются незначительными (0,106% и 0,182%).
Вывод
Проведена валидация методики идентификации таблеток Rinomax методом ВЭЖХ по параметру специфичность. Относительная погрешность специфичности вычисляется, как среднее значение разделения пиков на хроматограмме, которая составила не более 2%.





