Влияние щелочной среды на точность кондуктометрического титрования солей, подвергающихся гидролизу
Секция: Химия

XXXIX Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Влияние щелочной среды на точность кондуктометрического титрования солей, подвергающихся гидролизу
Введение
Электрохимические методы определения точек эквивалентности имеют ряд преимуществ (высокая чувствительность, быстрота выполнения, объективностью получаемых результатов) перед обыкновенными индикаторными методами титрования. В процессе электрохимического титрования наблюдение ведут не за изменением окраски раствора (так как в этом случае индикаторы не применяют), а за изменением электрохимических показателей титруемого раствора: электропроводности (кондуктометрическое титрование).
Сложности при ведении кондуктометрического титрования, наблюдаются, когда титруемые вещества подвергаются гидролизу. В таком случае, при измерении электропроводности на всем участке кривой титрования появляется погрешность при определении точной концентрации титруемых веществ, за счет присутствующих в растворе ионов, образующихся в процессе гидролиза.
Решением этой проблемы может стать использование сильных кислот и оснований в качестве веществ, препятствующих гидролизу [1]. В рамках данной работы рассматривается кондуктометрическое титрование солей карбоната натрия и фосфата натрия в среде избытка гидроксида натрия.
Метод исследования
В качестве аналитов в ходе эксперимента использованы растворы Na2CO3, Na3PO4. Раствор карбоната натрия был приготовлен из фиксанала, и разбавлен до 0,05 н концентрации, а раствор фосфата натрия, с 0,05 н концентрацией, из навески натрия фосфорнокислого 3-замещенного 12-водного. Зная исходную концентрацию аналитов, можно будет определить погрешность определения концентрации. С целью создания щелочной среды в растворы аналитов добавляли избыток NaOH (0,1 н), за титрант был взят раствор HCl (0,1 н). Частота снятия измерений значений электропроводности в ходе титрования проводилась с шагом в 0,1 мл, при температуре растворов 20-22 ºС.
Обсуждение результатов
I. Титрование Na2CO3
1) Титрование без добавления NaOH
После проведения титрования была построена кривая титрования (рисунок 1). На данной кривой обнаружены изломы (точки эквивалентности), определены процессы (образование HCO3–, нейтрализация HCO3–) происходящие на определенных участках кривой.
В результате кондуктометрического титрования была вычислена концентрация аналита, равная 0,033 н. Погрешность измерений составила 34 %.
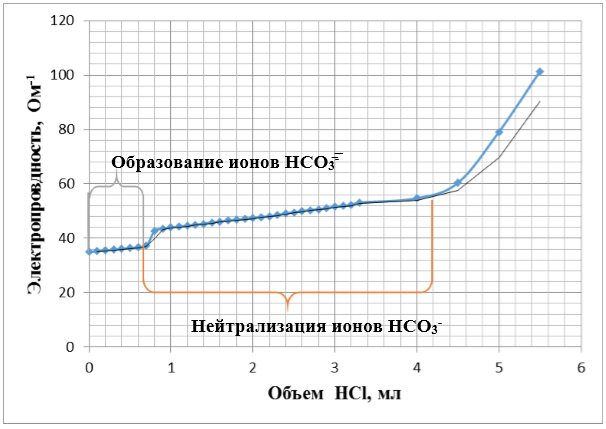
Рисунок 1. Кривая титрования Na2CO3 без добавления NaOH
2) Титрование с добавлением NaOH
По результатам титрования карбоната натрия соляной кислотой (с избытком гидроксида натрия) построена кривая (Рисунок 2). Выявлены процессы нейтрализации NaOH (объем титранта от 0 до 8,8 мл), и карбонат ионов (объем титранта от 8,8 до 13,9 мл).
В ходе вычисления количества аналита, была получена концентрация карбоната натрия равная 0,052 н. Погрешность измерений составила 4%, что значительно меньше, чем при титровании без использования избытка сильной щелочи в титруемом веществе.
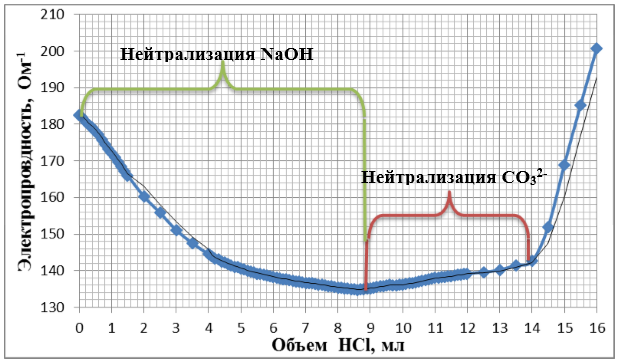
Рисунок 2. Кривая титрования Na2CO3 с добавление NaOH
II. Титрование Na3PO4
1) Титрование без добавления NaOH
Кривая титрования (рисунок 3) характеризуется наличием единственного излома в точке 3 мл объема затраченного титранта. Таким образом, по характеру полученной кривой титрования нет возможности определить какие кислотные остатки и с каким объемом кислоты реагируют.
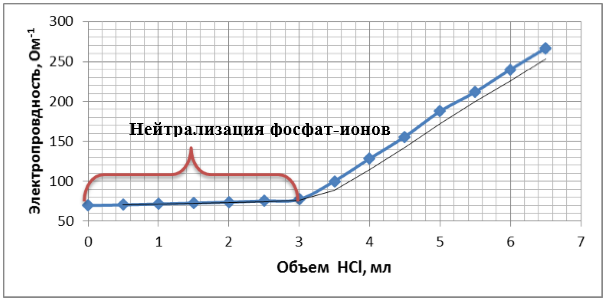
Рисунок 3. Кривая титрования Na3PO4 без добавления NaOH
2) Титрование с добавлением NaOH
Титрование Na3PO4 с присутствием щелочи (Рисунок 4) не дает существенного различия по сравнению с титрованием при ее отсутствии. Возможно, это обусловлено тем, что образующаяся в процессе титрования ортофосфорная кислота, достаточно хорошо диссоциирует [3], а, следовательно, образующиеся ионы гидроксония в процессе диссоциации, имеют вклад в значения электропроводности раствора [4].
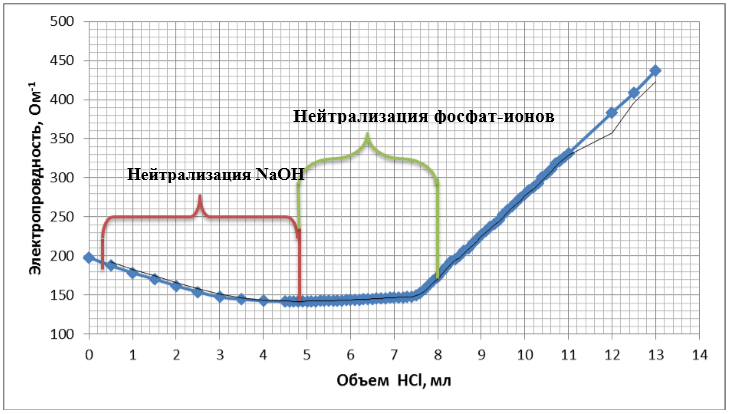
Рисунок 4. Кривая титрования Na3PO4 c добавлением NaOH
Заключение
Эмпирически, при титровании карбонат-ионов, было установлено, что присутствие щелочи в растворе аналита значительно облегчает определение изломов (точек эквивалентности), а также снижает погрешность при определении концентрации взятого раствора карбоната. Незначительная погрешность может создаваться из-за колебаний температуры раствора при проведении титрования.
Следует учесть, что добавление избытка щелочи не влияет на результат кондуктометрического титрования данной методикой фосфат-ионов. Применение избытка щелочи в ходе титрования солей фосфорной кислоты можно осуществить подбором подходящего титранта, при реакции с которым, образовавшиеся продукты, не повлияют на результат измерения электропроводности раствора фосфатов.





