Синтез гексаметилена бис[(метилоило) карбамата] и его химические свойства
Секция: Химия

XLII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Синтез гексаметилена бис[(метилоило) карбамата] и его химические свойства
Сегодня почти во всех областях техники, в сельском хозяйстве из производных карбаматов и бис-карбаматов выявлены некоторые, обладающие разнообразной активностью, например: в технике для повышения адгезии фторопластв[1]; F-промотор адгезии [2]; смачивающие вещества [3]; сшивающие агенты, для отвердения жидких покрытий [4]; в качестве стойкого клея [5];покрытия поверхностей [6]; в качестве пенопласта [7]; как высокоплавкие вещества [8]; в фотографических эмульсиях [9]; как антифоулинговое средство [10]; увеличивающие фоточувствительность полимеров в 16–50 раз [11] и многие другие. Кроме того, карбаматы использовались в качестве фунгицидных средств [12]. Этот список может быть предложен: так широка область применения производных карбаматов, бис-карбаматов и полиуретанов [10]. Поэтому поиск и синтез, а также технологии производных бис-карбаматов являются актуальной задачей современной органической химии.
Разработанный нами метод получения гексаметилен бис[(метилоило)карбамата] заключается в нуклеофильном присоединении (AN) метанола к гексаметилдиизоцианату при температуре 20–400С в присутствии растворителя и катализатора (основания), фильтрировании и сушке при температуре 155–1600С.
В процессе получения гексаметилен бис[(метилоило)карбамата] газообразные и твердые отходы не образуются. В качестве жидкого отхода образуется растворитель и катализатор, которые после регенерации используются в последующих операциях.
Конечный готовый продукт гексаметилен бис[(метилоило)карбамат] представляет собой бесцветный порошок с температурой плавления 102–1030С, растворяется в ДМФА, DMSO,HCOOHи в других органических растворителях.
Предлагаемый безотходный метод получения ростостимулятора технический растений ХМ-1 включает получение гексаметилен бис[(метилоило)карбамата] взаимодействием гексаметилендиизоционата с метанолом в присутствии катализатора триэтиламина и растворителя диметилформамида.
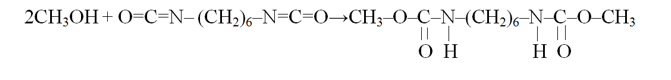
Химизм процесса:
Химическое поведение диизоцианатов наиболее полно согласуется с таким распределением электронных плотностей в –N=C=Oгруппе, которые описываются сопряжением следующих структур (I–III):
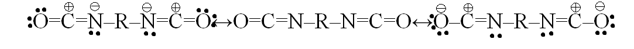
I II III
Азот и кислород в –N=C=O группе несут, в основном, отрицательный заряд и обладают электронодонорными свойствами. Поэтому эта группа подвержена как нуклеофильным, так и электрофильным атакам. В некоторых случаях диизоцианаты также могут играть роль электрофильныхтагентов. Наиболее типичны (характерны) для них реакции нуклеофильного присоединения с участием кислород- и азотосодержащих веществ.
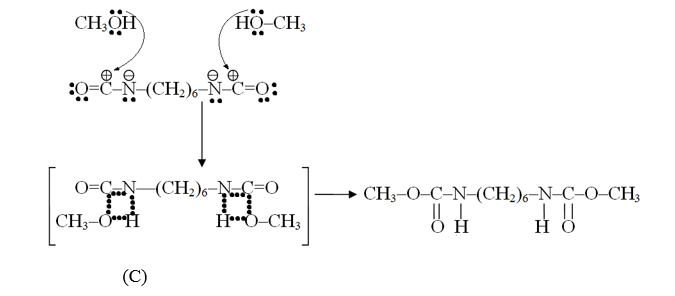
«ОН» группа метанола, имея свободную электронную пару, атакует электрофильный центр в молекуле гексаметилендиизоционата с образованием промежуточного продукта (С), который перегруппировывается в бис-карбамат: (C)
Химические превращения гексаметилен бис[(метилоило)карбамата]
1. Получение N,N’–динитрозозамещенные гексаметилен бис [(метилоило)карбамата]
Реакция нитрозирования производных бис-алкил-карбамаов является сравнительно мало исследованной.
По данным литературы и собственных исследований при нитрозировании реагируют атомы азота, непосредственно связанные с полиметиленовой цепью.
В результате реакции нитрозирования гексаметилен бис[(метилоило)карбамата] нитритом натрия (в избытке) в 98%-ной муравьиной кислоте при температуре 0+40С получены N,N’-динитрозозамещенные гексаметилен бис[(метилоило)карбамата] с выходами 71,2%.
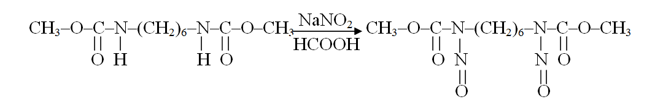
Реакция протекает по схеме:
I II
N-нитрование протекает по механизму электрофильного замещения. Атакующим агентом является нитрозный – ион NO+. Так как азотистая кислота, являющаяся наиболее распространенным нитрозирующим агентом, в свободно виде не существует, то для проведения процесса используют нитрат натрия и сильную кислоту (HCOOH). Образующаяся при этом азотистая кислота, присоединяя протон, генерирует ион NO+
или
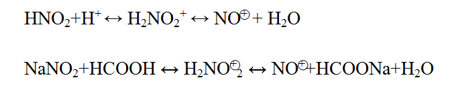
N,N`– динитрозирование ведется при охлаждении реакционной смеси. Повышения температуры нежелательно, так как это уменьшает выход целевого продукта, а иногда сказывается на направлении реакции.
Идентификацию N-нитрозосоединений проводят по полосам поглощения N-нитрозогрупп. Для >N-N=O групп характерна сильная полоса в области 1500-1430 см-1.
2. Получение N,N`– динатрийзамещенных гексаметилен бис [(метилоило)карбамата]
Одним из методов металлирования, который может быть осуществлен с применением N-металлирования, является замещением натрием атома водорода в N-H группе.
Гексаметилен бис[(метилоило)карбамат] подвергают направленному металлированию по N-H группам посредством с CH3ONa.
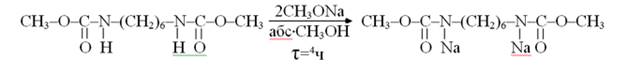
Реакция N,N`– диметилирования протекает по следующей схеме:
Синтез N,N’– динитрозозирование гексаметилен бис [(метилоило)карбамата]
В трехгорловую колбу, снабженную обратным холодильником, термометром, мешалкой, помещают 23,2 г (0,1 моль) растворенного в 200 мл муравьиной кислоты гексаметилен бис[(метилоило)карбамата]. При постоянном помешивании, при температуре 0-40С по порциям добавляют 0,5 нитрита натрия в избытке в течение 3,5–4,0 часов. После окончания реакции продукт выливают в литровый стакан, добавляют 500 мл холодной воды; отфильтровывают от выделившегося осадка, промывают бензолом и сушат. Индивидуальность N,N’- динитрозосоединений устанавливалась ТСХ на пластинках “Silifol”. Выход 21,53 г (71,3 %). Т.разл.=3000>
Найдено, % С 41,03 H 6,02 N 19,01
Вычислено
ДляC10H18N4O6, % C 41,38 H 6,20 N 19,31
Синтез N,N’-натрийзамещенного гексаметилен бис[(метилоило)карбамата]
В трехгорловую колбу, снабженную обратным холодильником с хлоркальциевой трубкой, автомешалкой, термометром помещают CH2Ona (из 0,031 г/моль Naи 30 мл абсолютированного метанола) прибавляют 2,32 г (0,01 моль) гексаметилен бис[(метилоило)карбамата]. Смесь перемешивают 2 часа при 200С и 2 часа при 400С, осадок отфильтровывают, промывают аюсолютным метанолом и получают N,N’-динатрий гексаметилен бис[(метилоило)карбамат].
Выход 1,92 г (69,1%). Т.пл.=3000С(разл.)
Найдено, %: N 9,88
Вычислено для
C10H18Na2N2O4, %: N 10,14





