Исследование воздействий вируса мозаики проса (PMV) в комбинации с его сателлитом (SPMV)
Конференция: XXII Международная научно-практическая конференция «Научный форум: инновационная наука»
Секция: Технические науки

XXII Международная научно-практическая конференция «Научный форум: инновационная наука»
Исследование воздействий вируса мозаики проса (PMV) в комбинации с его сателлитом (SPMV)
Материалы и методы исследования
Растения. Просо обыкновенное (P. miliaceum) и просо итальянское (Setaria italica) выращивают в тепличной камере при 28°C, 14 ч света и 24°C, 10 ч темноты. Просо во время появления третьего листа механически инокулируют, смешивая равные объемы 5-концевые некэпируемые транскрипты РНК и буфер для инокуляции РНК [1].
Транскрипция in vitro и трансляция in vitro. Для получения линейной ДНК матрицы, для реакций транскрипции in vitro, очищенные плазмиды, содержащие полноразмерную кДНК PMV, расщепляют с помощью EcoICR1 и плазмиды, несущие SPMV или мутагенизированные кДНК SPMV расщепляют BglII [2].
Маркировка метионинового белка [35S]. Через две недели после прорастания, проростки проса механически заражали смесью PMV и SPMV. Через 5 дней после инокуляции растения переносили в дистиллированную воду, содержащую 0,5 мКи [35S] метионина. Затем после 6 дней инкубации в присутствии [35S] метиониновых общих белков были выделены из листьев проса, а экстракты были подвергнуты иммунопреципитации.
Иммунопреципитация. Сразу после сбора, 1 г листьев быстрозамороженных в жидком азоте измельчают в ступке с 1,5 мл ледяной экстракционной среды {150 мМ HEPES (pH 7,5), 0,5% Triton X-100, 0,2% 3 - [(3-холамидопропил) диметиламмонио] -1-пропансульфоната, 150 мМ NaCl, 1 мМ ЭДТА, 2 мМ дитиотреитол (DTT)} с ингибитором протеазы. Гомогенизированный растительный материал центрифугировали при 10000 g при 4°C в течение 15 минут. Полученный супернатант был использован для иммунопреципитации.
800 мл экстракта смешивали с 2 мл PMV КБ (капсидный белок) - или SPMV КБ-специфичные кроличьи поликлональные антитела центрифугировали в течение 2 ч при 4°С с последующим добавлением 30 мкл ImmunoPure IgG [1]. Затем образцы инкубировали при комнатной температуре 2 часа, шесть раз промывали ледяным экстракционным буфером и иммунопреципитированный материал разделили на додецилсульфат натрия - 12% полиакриламидный гель с помощью электрофореза с последующим вестерн-блоттингом.
Специфичность антисыворотки против SPMV была подтверждена иммунопреципитацией меченного [35S] метионина капсидного белка, который был синтезирован in vitro, трансляцией полноразмерных транскриптов SPMV [3].
Вестерн-блоттинг. Образцы белка разделяли с помощью додецилсульфат натрия - 15% полиакриламидный гель и переносятся на нитроцеллюлозные мембраны. После переноса мембраны окрашивали для проверки эффективности переноса белка. SPMV КБ антитела и антитела к PMV КБ разводили 1:2000 и 1:5000 соответственно.
Направленный мутагенез. Набор QuikChange был использован для направленного мутагенеза. SPMV / U-91 был получен путем введения урацила (U) (тимидина [T] в клон кДНК) непосредственно в первый стартовый кодон SPMV КБ в положении nt 88 кДНК SPMV. SPMV / U-301 был получен из мутанта SPMV / U-91 с дополнительным введением урацила (U) (тимидина [T] в клон кДНК) сразу после кодона AUG в положении 297. Мутант SPMV-AUG с заменой оригинального стартового кодона AUG на нуклеотиде 88 кодона AUG. Мутант SPMV / UAA-234 был создан путем замены шести нуклеотидов непосредственно перед вторым AUG (подчеркнуто; nt 235), изменение последовательности SPMV с 5-AAGGGGAUG-3 на 5-UGAUAAAU G-3. Все мутации были подтверждены путем секвенирования всей кДНК SPMV [4].
Конструирование делеционных мутантов SPMV. Клоны кДНК SPMV разрезали с помощью выбранных рестрикционных ферментов в различных комбинациях. Мутанты SPMV были получены путем расщепления кДНК полноразмерной SPMV или SPMV / AUG с SpeI и BamHI.
РНК-анализ. Всего РНК из 100 мг инокулированных или системно инфицированных листьев проса были экстрагированы при 14 dpi. Образцы измельчали в 1 мл ледяного экстракционного буфера (100 мМ Трис-HCl [pH 8,0], 1 мМ ETDA, 0,1М NaCl и 1% SDS) и дважды экстрагируют фенол-хлороформом в соотношении 1:1 при комнатной температуре. Общую РНК осаждают с помощью 8 М хлорида лития при 4°С в течение 1 часа. Полученные гранулы промывают 70% этанолом, ресуспендируют в дистиллированной воде без РНКазы и используют для гибридизации по Нозерну. Приблизительно 10 г всей растительной РНК электрофоретически разделяют в 1% агарозных гелях и переносят на нейлоновые мембраны [1]. РНК PMV и SPMV были обнаружены путем гибридизации с [32P].
Результаты исследований
Иммуноблот анализы просо обыкновенное и просо итальянское, коинфицированные PMV SPMV и анализы in vitro трансляции РНК SPMV обычно включают несколько SPMV КБ – специфика в меньших количествах коротких полос. Это наблюдение было особенно очевидно, когда листья зараженных растений подвергали SDS-PAGE с последующим иммуноблот-анализом. Добавление ингибитора протеазы в экстракционный раствор не препятствовало обнаружению более мелких полос белка, экстрагированных из PMV SPMV. Наличие четырех стартовых кодонов в последовательности CP SPMV, при nt 88 (обозначается как AUG1), nt 235 (AUG2), nt 297 (AUG3), и nt 364 (AUG4), подразумевает вероятность того, что белки с более низкой молекулярной массой могут быть оригинальными SPMV КБ (рис.1). Сайты рестрикционных ферментов, используемые для сборки кДНК, и положения предсказанных встроенных стартовых кодонов указаны стрелками.

Рисунок 1. Схематическое изображение 824-нт SPMV РНК (сплошная линия) и полной длины 17 кДа
Стрелки указывают на КБ – это специфичные белки SPMV и их молекулярные массы. Экстракция КБ из растений, инфицированных PMV, под воздействием SPMV, т. е родственные денатурирующие условия позволяют надежно обнаруживать белок SPMV 17 кДа методом вестерн-блоттинга.
9,4 кДа, экспрессируемый SPMV / U-91, не был обнаружен при схожих условия (рис. 2), но добавление 2% Triton X-100 к экстракционному буферу допускает его присутствие.
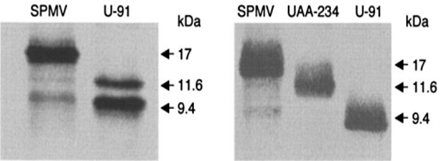
Рисунок 2. 9,4 кДа, экспрессируемый SPMV / U-91 при схожих условиях
Три белка были обнаружены, и иммунопреципитация с антисывороткой, специфичной к КБ SPMV, подтвердила, что это представлены продукты КБ. Также обнаружено, что значительное количество SPMV КБ локализовано в цитозоле, но наибольшее накопление наблюдалось в мембране и клеточной стенке. Серологическое выявление КБ SPMV у проса собирали через 14 дней после инокуляции PMV плюс SPMV или PMV плюс SPMV / U-91. Фракционирование клеточных белков дифференциальным центрифугированием представлено БКС (белки клеточной стенки), S30 (цитозольные белки) и P30 (мембраны).
Белки были разделены с помощью SDS-PAGE и проанализированы вестерн-блоттингом с использованием КБ-специфичной антисыворотки к SPMV. Растения, зараженные PMVи SPMV. Растения, зараженные PMV и SPMV / U-91. SPMV КБ специфически взаимодействует с КБ PMV. Изучили взаимодействия между капсидным белком SPMV и кодируемыми PMV белками для изучения потенциальных взаимодействий с носителем белка, провели эксперименты. Для этой цели in vivo [35S] метиониновый белок маркирует здоровые и инфицированные PMV и SPMV растения, вместе с иммунопреципитацией -специфичной антисывороткой к SPMV.
Наряду с ожидаемым капсидным белок 17 кДа SPMV, были обнаружены два других белка с молекулярными массами приблизительно 26 и 40 кДа. КБ 40 кДа также легко обнаруживается в экстрактах инокулированных (здоровых) растениях, подвергнутых анализу иммунопреципитации.


