РНК-хеликаза MLE взаимодействует с компонентами ENY2-содержащих белковых комплексов
Конференция: XXVII Международная научно-практическая конференция «Научный форум: инновационная наука»
Секция: Биология

XXVII Международная научно-практическая конференция «Научный форум: инновационная наука»
РНК-хеликаза MLE взаимодействует с компонентами ENY2-содержащих белковых комплексов
RNA helicase MLE interacts with the components of ENY2-containing protein complexes
Julia Nikolenko
Ph.D,researcher, Institute of Gene Biology, Russian Academy of Sciences, Russia, Moscow
Maria Kurshakova
Ph.D, researcher, Institute of Gene Biology, Russian Academy of Sciences, Russia, Moscow
Aleksey Krasnov
Ph.D, leading researcher, Institute of Gene Biology, Russian Academy of Sciences, Russia, Moscow
Аннотация. В нашей предыдущей работе было обнаружено взаимодействие ENY2 и РНК-хеликазы MLE у Drosophila melanogaster. Целью данной работы было дальнейшее исследование этого взаимодействия in vivo. Методом иммунопреципитации в настоящей работе было показано, что MLE взаимодействует с рядом компонентов ENY2-содержащих белковых комплексов. Мы предполагаем, что эти взаимодействия важны для работы MLE вне комплекса дозовой компенсации.
Abstract. In our previous work, the interaction of ENY2 and MLE RNA helicase was discovered in Drosophila melanogaster. The aim of this work was to further study this interaction in vivo. In the present work, it was shown using immunoprecipitation method, that MLE interacts with a number of components of ENY2-containing protein complexes. We suggest that these interactions are important for the functioning of MLE beyond dosage compensation.
Ключевые слова: ENY2; MLE; РНК-хеликаза; экспрессия генов.
Keywords: ENY2; MLE; RNA helicase; gene expression.
Белок ENY2 исходно был обнаружен и описан, как транскрипционный коактиватор и как фактор, влияющий на взаимодействие промоторов и энхансеров [4]. В дальнейших исследованиях методами скрининга в дрожжевой двугибридной системе и очистки белковых комплексов из ядерного экстракта было показано, что ENY2 взаимодействует с рядом белков-партнеров и ассоциирован с несколькими мультибелковыми комплексами, в том числе SAGA, TREX, TREX-2 и ORC [7].
SAGA (Spt-Ada-Gcn5 Acetyltransferase) - это хроматин-модифицирующий комплекс, консервативный у дрожжей, D. melanogaster и человека. У D. melanogaster в его составе идентифицирован 21 белок [14, 15]. Комплекс SAGA обладает двумя разными ферментативными активностями: способностью ацетилировать и деубиквитинировать гистоны. Первую функцию у D. melanogaster в составе основного модуля комплекса осуществляет гистонацетилтрансфераза Gcn5, способная ацетилировать остатки лизина в гистонах Н3 и Н4. Вторую осуществляет так называемый DUB-модуль (деубиквитиназный модуль), соcтоящий у D. melanogaster из трех белков: собственно ENY2, Non-stop и Sgf11 [5]. Non-stop деубиквитинирует гистон H2B на промоторах активно транскрибирующихся генов, что способствует элонгации транскрипции.
TREX-2/AMEX (Transcription and export complex-2 /Anchoring and mRNA export complex) - комплекс, состоящий из трех консервативных белков: собственно ENY2, PCID2 и Xmas-2, необходимый для экспорта мРНК в цитоплазму через ядерные поры [10].
TREX (Transcription and export complex) - эволюционно консервативным мультибелковый комплекс, который играет основную роль в функциональном соединении различных этапов биогенеза мРНК, включая транскрипцию мРНК, процессинг, формирование мРНП-частиц, деградацию РНК и ядерный экспорт [6]. TREX включает комплекс THO, который у D. melanogaster состоит из THO2, HPR1, THOC5, THOC6 и THOC7, участвующий в биогенезе мРНП, а также белки Hel25E, Ref1, и tex. ENY2 стабильно ассоциируется с ТНО комплексом и необходим для его рекрутирования на новосинтезированную мРНК. При этом в этом процессе ENY2 действует независимо от от SAGA и TREX-2. Вероятно рекрутирование ENY-THO происходит котранскрипционно, в то время как компонент комплекса TREX-2, Xmas-2 загружается на мРНК на более поздней стадии. Было показано, что ENY-THO играет важную роль в процессинге 3'-конца мРНК [8].
ORC (Origin recognition complex) - комплекс из 6 субъединиц, ORC1-6, у эукариот связывается с точками начала репликации и инициирует сборку пре-репликативного комплекса. Недавно у D. melanogaster было показано прямое взаимодействие ORC с TREX-2. Это взаимодействие происходит через несколько субъединиц и важно для жизнеспособности . D melanogaster. Кроме того, ORC связывается с мРНП, и с рецептором Nxf1, опосредуя экспорт мРНК из ядра [9].
Su(Hw) - главный белок Su(Hw)-зависимых инсуляторов, содержащий 12 доменов "цинковых пальцев" типа С2Н2, взаимодействующий с ENY2 и привлекающий ENY2-содержащие комплексы на инсуляторы. Такое рекрутирование комплексов важно для определения точек начала репликации и регуляции транскрипции [11, 17].
CG9890 – ядерный белок, содержащий домены "цинковых пальцев" типа С2Н2. CG9890 взаимодействует с ENY2, коиммунопреципитируется с крмпонентами ENY2-содержащих комплексов и предположительно (по аналогии с Su(Hw)) привлекает эти комплексы на ДНК [3].
Таким образом, ENY2, как общая субъединица нескольких белковых комплексов, осуществляющих последовательные этапы экспрессии генов, играет важную роль в координации этих этапов [7]. Краткая информация о компонентах ENY2-содержащих комплексов, задействованных в настоящем исследовании, суммирована в таблице 1.
Таблица 1.
ENY2-содержащие комплексы и белки партнеры ENY2
|
Белок |
Комплекс |
Функция |
|
Gcn5 |
SAGA
|
Ацетилирование и деубиквитинирование гистонов, регуляция активации транскрипции ряда генов. |
|
Thoc5 |
TREX
|
Формирование мРНП - частиц, связь транскрипции с экспортом мРНК. |
|
Xmas-2 |
TREX-2/AMEX
|
Взаимодействие с ядерной порой, экспорт мРНК. |
|
Su(Hw) |
-
|
Сиквенс-специфическое связывание с ДНК, обеспечение работы Su(Hw)-зависимых инсуляторов, регуляция транскрипции, позиционирование точек начала репликации. |
|
CG9890 |
- |
Предположительно: привлечение ENY2 -содержащих комплексов на ДНК. |
|
ORC2, ORC3 |
ORC
|
Инициация репликации ДНК, участие в экспорте мРНК. |
В нашей предыдущей работе было обнаружено и подтверждено разными методами взаимодействие ENY2 и MLE [1]. MLE относится к консервативному семейству хеликаз, содержащих мотив DExH-бокс. Эти хеликазы способны связывать и расплетать двухцепочечные нуклеиновые кислоты, ремоделировать "шпильки" в одноцепочечной РНК и РНК-белковые комплексы. Для РНК-хеликазы А, гомолога MLE у человека, показано участие во многих процессах, связанных с экспрессией генов [12]. В то же время для самой MLE наиболее изученной функцией остается специфичная для самцов D. melanogaster роль в комплексе дозовой компенсации [16]. В научной литературе есть отдельные данные об участии MLE в универсальных для обоих полов процессах, но механизм работы MLE в них неизвестен [2, 13].
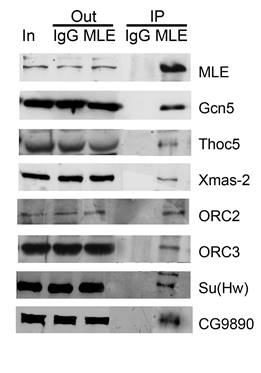
Рисунок 1. Анализ взаимодействия MLE с компонентами ENY2-содержащих комплексов
В настоящей работе было исследовано взаимодействия MLE с компонентами ENY2-содержащих комплексов. При помощи полученных ранее в нашей лаборатории антител были поставлены экcперименты по коиммунопреципитации. На рисунке 1 представлены результаты вестерн-блот-анализа иммунопреципитированных белков (IP), исходная фракция эмбрионального ядерного экстракта (In), фракция эмбрионального ядерного экстракта после инкубации с антителами (Out). IgG - преимунная сыворотка, которая служит контролем иммунопреципитации. Полученные результаты подтверждают взаимодействие MLE и компонентами комплексов SAGA, TREX, TREX-2, ORC и с белками Su(Hw) и CG9890. Аналогичные результаты были получены при использовании экстракта из культуры клеток D. melanogaster Schneider2 (S2).
В нашей предыдущей работе были получены данные, указывающие на то, что взаимодействие ENY2 и MLE важно для работы MLE вне дозовой компенсации [1]. Мы предполагаем, что хеликазная активность MLE важна для работы ENY2-содержащих комплексов в процессах биогенеза РНК. Полученные в данной работе результаты послужат основой для дальнейших исследований.
Благодарности: Данная работа была поддержана грантом Российского фонда фундаментальных исследований №18-04-01019.


