Противоопухолевая активность онколитического штамма ЖЭВ14 in vivo на модели подкожных ксенографтов клеток рака предстательной железы в иммунодефицитных мышах
Конференция: XIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Молекулярная биология

XIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Противоопухолевая активность онколитического штамма ЖЭВ14 in vivo на модели подкожных ксенографтов клеток рака предстательной железы в иммунодефицитных мышах
Antitumor activity of oncolytic strain LEV14 in vivo on the model of subcutaneous xenografts of prostate cancer cells in immunodeficient mice
Anastasia Sosnovtseva
graduate student, Engelhardt Institute of Molecular Biology RAS, Moscow
Pirogov Russian National Medical University, Ministry of Health of the Russian Federation, Russia, Moscow
Anastasia Lipatova
junior researcher Engelhardt Institute of Molecular Biology RAS, Russia, Moscow
Andrei Zheltukhin
junior researcher Engelhardt Institute of Molecular Biology RAS, Russia , Moscow
Аннотация. В работе проводится оценка эффективности непатогенного онколитического штамма ЖЭВ14, родственного вирусу Коксаки В5 на модели ксенографтов первичной линии клеток аденокарциномы предстательной железы. После подтверждения литической активности вируса в опытах in vitro была оценена динамика регрессии опухолей на модели in vivo, что подтвердило высокую эффективность прямого онколитического действия ЖЭВ14.
Abstract. We evaluated the efficacy of the nonpathogenic oncolytic strain LEV14, related to the Coxsackievirus В5 on the xenograft model of the primary cell line of prostate adenocarcinoma. After confirming the lytic activity of the virus in vitro, the dynamics of tumor regression on in vivo model was evaluated, which confirmed the high efficacy of direct oncolytic action of LEV14
Ключевые слова: онколитические вирусы; первичные линии; энтеровирус; вирусы группы Коксаки.
Keywords: oncolytic viruses; primary lines; enterovirus; Coxsackie viruses.
Введение
Вирусный онколиз является перспективным подходом к терапии метастатического рака [1-3]. Онколитические штаммы в вирусов обладают способностью избирательно уничтожать опухолевые клетки и стимулировать противоопухолевый иммунитет, не оказывая серьезных побочных эффектов на пациентов в процессе терапии [4]. Одними из наиболее перспективных вирусных онколитиков являются представители семейства энтеровирусов. Энтеровирусом является и Rigvir [5], один из трех утвержденных к клиническому применению вирусных препаратов, генетически стабильный штамм вируса Эхо7, применяемый в настоящее время для лечения меланом и других форм злокачественных новообразований в Латвии. Многие другие штаммы энтеровирусов также обладают природными онколитическими свойствами [6]. В середине прошлого столетия от здоровых детей был выделен ряд штаммов энтеровирусов относящихся к группам Коксаки и Эхо, которые не обладали патогенностью и использовались в качестве живых энтеровирусных вакцин (ЖЭВ) для профилактики сезонных вирусных инфекций [7]. Было установлено, что многие из этих штаммов обладали природными онколитическими свойствами [8-10]. Объектом изучения в данной работе является штамм ЖЭВ14 (Живая энтеровирусная вакцина 14), родственный Коксаки В5.
Результаты и обсуждение
Первичная линия аденокарциномы предстательной железы PRC3 была полученна от пациента в ходе простатоэктомии и прошла ограниченное число пассажей in vitro. При оценке туморогенности на иммунодефицитных мышах было обнаружено, что клетки PRC3 способны образовывать медленнорастущие опухоли при подкожной инъекции 2х106 клеток. Объем опухолей через 35-37 суток достигал 1-1,2 см3.
Для оценки чувствительности клеток PRC3 к вирусу in vitro клетки рассевали в лунки 96-луночных плоскодонных планшетов в количестве 5 тысяч на лунку, после чего на следующий день проводили заражение вирусом в широком диапазоне множественности заражения (MOI =100, 10, 1, 0,1, 0,01, 0,001, 0,0001). Через 72 часа после заражения проводили оценку литической активности путем проведения колориметрического теста с применением MTS-реагента (Promega). Расчет величины TCID50 проводили по методу Рида и Менча [11]. В качестве эталона проводили параллельное заражение чувствительной культуры клеток рабдомиораркомы человека RD. Чувствительность обеих культур оказалась практически одинаковой и соответствовала lgTCID50=8,57.
Для проведения экспериментов in vivo 28 животным было подкожно привито по 2*106 клеток. На 22 день, когда средний объем опухолей был около 430 мм3 16 животным, включенным в опытную группу, через хвостовую вену однократно вводили по 107 инфекционных единиц (и.е.) вируса ЖЭВ14. Измерение объема опухоли проводили через каждые 3 дня после введения вируса (Рис. 1). Через 41 день после начала эксперимента опыт был прекращен в связи с тем, что у животных в контрольной группе объем ксенографтов превысил 1,5 см3. Использованные в эксперименте животные были подвергнуты эвтаназии.
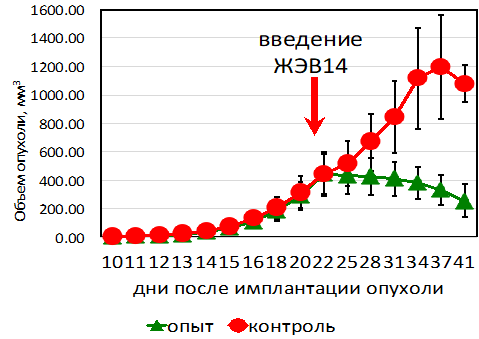
Рисунок 1. Объем ксенографтов клеток PRC3 в контрольной группе и после терапии ЖЭВ14
Из представленного графика видно, что уменьшение объемов ксенографтов заметно уже через 10 дней после проведения терапии, в то время как у животных из контрольной группы опухоли продолжали активно развиваться. Оценка динамики объема ксенографтов, представленная в виде показателя Т/С (Рис. 2), где Т (treatment) – средний объем опухоли в опытной группе, и С (control) – средний объем опухоли в контрольной группе.
Статистически значимое снижение объема ксенографтов может быть зарегистрировано уже на 12 день после введения вируса.
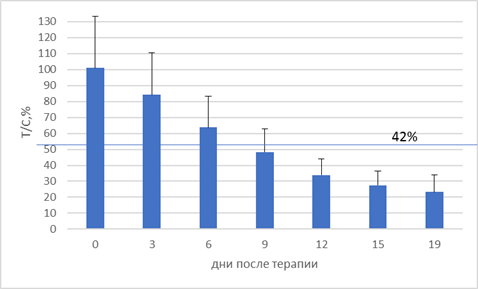
Рисунок 2. Динамика регрессии ксенографтов аденокарциномы предстательной железы PRC3 после введения терапии
Из результатов данных экспериментов следует, что онколитический штамм ЖЭВ14 обладает способностью оказывать прямое онколитическое действие в иммунодефицитных животных при испытании на ксенографтах, образованных чувствительными к вирусу клеткам аденокарциномы предстательной железы человека.
Работа выполнена при финансовой поддержке Министерства Образования и Науки РФ в рамках Соглашения о предоставлении субсидии № 14.607.21.0014, уникальный идентификатор проекта - RFMEFI60714X0014.


