Исследование термоденатурационных свойств растворов оксигемоглобина, модифицированных антибиотиками различных классов
Конференция: V Международная заочная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Химиотерапия и антибиотики

V Международная заочная научно-практическая конференция «Научный форум: медицина, биология и химия»
Исследование термоденатурационных свойств растворов оксигемоглобина, модифицированных антибиотиками различных классов
Аннотация. Представлены результаты исследования влияния антибактериальных препаратов различных классов на структурно-функциональные свойства гемоглобина человека. Установлено, что молекулярные комплексы исследуемых антибиотиков с гемоглобином характеризуются изменением термоустойчивости по сравнению с немодифицированным гембелком. Показано, что степень активности антибиотиков в отношении оксигемоглобина определяется их концентрацией и химической природой модификатора.
Abstract. The article under consideration presents the results of research of the influence of antibacterial substances of different nature on structurally functional properties of human hemoglobin. It was established that molecular complexes of the examined antibiotics with oxyhemoglobin are characterized by changed thermostability in comparison with unmodified protein. It was revealed that the level of activity of antibiotics in relation to oxyhemoglobin is determined by their concentration and the chemical nature of the modifier.
Ключевые слова: антибиотики, гемоглобин, тепловая денатурация.
Keywords: antibiotics, hemoglobin, thermodenaturation.
Введение
Многолетние исследования в области биофизики белка, изучения особенностей его пространственной организации, становления третичной и, особенно, четвертичной структуры позволили выявить ряд закономерностей, лежащих в основе функционирования биологических систем организма [2; 6–9; 14]. Являясь неотъемлемыми структурно-функциональными элементами отдельных клеток и физиологических сред, белковые молекулы выполняют ряд жизненно важных функций, участвующих в поддержания гомеостаза. Так, белки плазмы и форменных элементов крови участвуют в транспорте питательных веществ, обеспечении защитной, дыхательной, регуляторной функций. Поэтому особую значимость имеет сохранение их нативного структурно-функционального состояния при изменении условий микроокружения. Одним из наиболее важных моментов в условиях патологического процесса является сохранение газотранспортной функции гемоглобина – основного компонента эритроцитарного матрикса. Использование лекарственных препаратов, в частности антибиотиков, способно привести к изменению нативной конформации гемопротеида и, как следствие, к ухудшению степени его связывания с кислородом [3–5]. Представляло интерес оценить конформационное состояние внутриэритроцитарного гемоглобина человека при исследовании его термоденатурационных свойств в присутствии антибиотиков различных классов.
Объекты и методы исследования
В опытах использовали водные растворы оксигемоглобина в концентрации 5·10-5 моль/л, выделенного из эритроцитов донорской крови путем их осмотического гемолиза. Контрольный и опытный растворы термостатировали на водяной бане типа LW-2 при 20, 37 и 55 °C. Время инкубации составляло 30 мин. Подвергнутые воздействию повышенной температуры (37 и 55°C) белковые растворы охлаждали до комнатной температуры 23°C. О термохимических превращениях глобина донорской крови мы судили по величине светорассеяния ( ), которая связана пропорциональной зависимостью с размерами и формой исследуемых частиц [1; 2]. Состояние последних оценивали косвенным методом – путем измерения величин интенсивности светопропускания нативных и денатурированных образцов с последующим перерасчетом в величины светопоглощения. В опытах использовали стеклянные кюветы объемом 5 мл с длиной оптического пути 10 мм, концентрационный фотоколориметр КФК-3 (длина волны измерения – 490 нм, т.к. при этой длине волны коэффициент молярной экстинкции гемоглобина минимален). В качестве исследуемых растворов рассматривались нативный НbО2 (контроль) и гемоглобин, модифицированный антибиотиками.
), которая связана пропорциональной зависимостью с размерами и формой исследуемых частиц [1; 2]. Состояние последних оценивали косвенным методом – путем измерения величин интенсивности светопропускания нативных и денатурированных образцов с последующим перерасчетом в величины светопоглощения. В опытах использовали стеклянные кюветы объемом 5 мл с длиной оптического пути 10 мм, концентрационный фотоколориметр КФК-3 (длина волны измерения – 490 нм, т.к. при этой длине волны коэффициент молярной экстинкции гемоглобина минимален). В качестве исследуемых растворов рассматривались нативный НbО2 (контроль) и гемоглобин, модифицированный антибиотиками.
Выбор антибиотиков для проведения исследования был определен широким распространением их в клинической практике. Ввиду того, что в плановой практической медицине больному назначают лекарственное средство в средней терапевтической дозе [5], расчет концентрации антибиотиков мы проводили с учетом разовой дозы препарата: 1) класс аминогликозиды: амикацин – 0,25 г; 2) класс фторхинолоны: ципрофлоксацин – 0,5 г; 3) класс цефалоспорины: цефтазидим (фортум) – 0,5 г; 4) класс гликопептиды: ванкомицин – 0,5 г. Для установления возможной зависимости структурных свойств белка от содержания антибиотиков в инкубационной среде препараты применяли в 2-х концентрациях: терапевтической и на порядок ниже.
Результаты и их обсуждение
При кратковременном и длительном взаимодействии антимикробных препаратов с гемоглобином при 55 °С регистрировали статистически значимые изменения интенсивности светорассеяния в растворах белка относительно контроля. Для изученных антибиотиков выявлена зависимость величины светорассеяния от концентрации модификаторов в среде: чем больше содержание препарата, тем сильнее он влияет на величину  . Установлена обратно пропорциональная зависимость количества образующихся комплексов «антибиотик – гемоглобин» от времени их взаимодействия с белком (рис. 1). При анализе полученных данных нами был сделан вывод о том, что ципрофлоксацин и ванкомицин в терапевтических концентрациях являются активными химическими модификаторами, вступающими в реакцию этерификации благодаря наличию в своей структуре СООН-группы с аминокислотными остатками тирозина, а возможно и лизина гемоглобина (рис. 2).
. Установлена обратно пропорциональная зависимость количества образующихся комплексов «антибиотик – гемоглобин» от времени их взаимодействия с белком (рис. 1). При анализе полученных данных нами был сделан вывод о том, что ципрофлоксацин и ванкомицин в терапевтических концентрациях являются активными химическими модификаторами, вступающими в реакцию этерификации благодаря наличию в своей структуре СООН-группы с аминокислотными остатками тирозина, а возможно и лизина гемоглобина (рис. 2).
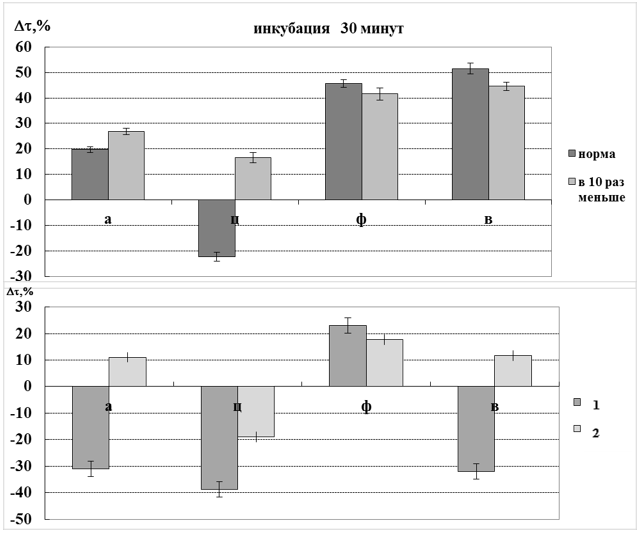
Рисунок 1. Комбинированное влияние антибиотиков и температуры 55 0С на интенсивность светорассеяния гемоглобина. Обозначения: а – амикацин, ц – ципрофлоксацин, ф – фортум, в – ванкомицин; 1 – терапевтическая концентрация антибиотиков, 2 – концентрация антибиотиков, на порядок ниже терапевтической

Рисунок 2. Структурные формулы ванкомицина (а) и ципрофлоксацина (б)
Как следует из рис.1, ципрофлоксацин обладает высокой скоростью встраивания в структуру белка, упрочивая связи, стабилизирующие его пространственную организацию, что указывает на низкий уровень барьера стерических ограничений. Молекула ванкомицина сильно полярна, но мало заряжена. Образование ковалентных связей является приоритетным для данного антибиотика. По-видимому, нейтрализация локального отрицательного заряда происходит за счёт электростатических взаимодействий, что приводит к возникновению частичной устойчивости структуры молекулы к действию температуры за счёт увеличения поверхности гидрофобных участков. По всей вероятности, карбоксильные группы данных антибиотиков принимают участие в образовании ионной связи с аминными группами гембелка, за счёт чего наблюдается экранирование отрицательного заряда. Согласно полученным данным, фортум характеризуется высоким стерическим соответствием к пространственной структуре белка, повышая величину  его растворов до ≈ 40% относительно контроля при длительной инкубации с ним.
его растворов до ≈ 40% относительно контроля при длительной инкубации с ним.
При комнатной температуре все исследованные нами антибиотики уже на начальных этапах взаимодействия с гемоглобином вызывали аутоденатурационный эффект, однако, регистрируемые изменения нативной структуры гембелка были статистически не достоверны по отношению к контролю. При повышении температуры до физиологической лишь после 30-минутной инкубации растворов гемоглобина с антибиотиками мы регистрировали незначительное приращение параметра  не более чем на 1 % для исследуемых антимикробных препаратов. Полученные в данной серии результаты позволили констатировать, что антибиотики – модификаторы индуцируют структурные изменения вследствие образования комплексов с белком, а также разрушение или ослабление связей, стабилизирующих его пространственную структуру.
не более чем на 1 % для исследуемых антимикробных препаратов. Полученные в данной серии результаты позволили констатировать, что антибиотики – модификаторы индуцируют структурные изменения вследствие образования комплексов с белком, а также разрушение или ослабление связей, стабилизирующих его пространственную структуру.
Под термином денатурации белка принято понимать любую модификацию высших типов его пространственной организации без разрыва химических связей, сопровождающуюся, как правило, изменением функциональных свойств [2]. В водных растворах степень денатурационного воздействия очень тесно связана с температурой и рН среды, а стабильность белков зависит от изменения баланса и природы энергии между сформированными и несформированными участками [7,10,13]. Энергия белка является функцией топологического расположения атомов, своего рода «энергетическим ландшафтом» для каждого типа белка. Геометрия этого «ландшафта» не может быть значительно изменена модификацией нескольких изолированных участков, а влияние гидрофобных взаимодействий, определяемых энтропией, S, прямо пропорционально поверхности количества сольватированных молекул воды в первой оболочке сольватации [10,11]. Исходя из вышесказанного и полученных нами данных, можно предположить, что воздействие изучаемых антибиотиков на молекулы гемоглобина приводит к изменению его пространственной организации за счёт нарушения связей и взаимодействий, стабилизирующих глобулу.
Известно, что белки становятся более стабильными с увеличением отрицательной величины G, а их термодинамическое поведение определяется различными температурными скачками и внешними термостабилизирующими факторами [6,12,14]. Одним из термодинамических параметров системы является энтропия – мера неупорядоченности или вероятности состояния системы. Она увеличивается при повышении температуры за счёт теплового движения молекул [2]. При повышении температуры энтропийный член (TΔS) возрастает, что ослабляет прочность внутримолекулярных связей, обеспечивающих структурную устойчивость всей глобулы. Уменьшение количества или энергии межатомных взаимодействий, вызванных химической модификацией макромолекулы, природа лиганда, связанного с гемоглобином, делают его более чувствительным к действию температуры [2]. Поэтому можно констатировать, что повышение интенсивности светорассеяния в растворах гембелка от нагревания подчиняется прямой пропорциональной зависимости, определяемой соотношением двух противоположно направленных процессов: разрыхлением белковой глобулы, вызываемым нарушением внутримолекулярных взаимодействий между её полипептидными цепями, и сжатием тетрамера, обусловленным повышением гидрофобности его поверхности. При разупорядочивании белковых молекул наблюдается повышение реактивности сульфгидрильных групп цистеина, фенольных — тирозина; гуанидиновых — аргинина; S-аминогрупп — лизина и др. А это сопровождается усилением склонности белковых молекул к агрегации [8; 9].
Заключение.
Таким образом, изменение интенсивности светорассеяния, регистрируемое нами в проведенной серии опытов, свидетельствует о нарушении стабильности молекулы гемоглобина. Наибольшую химическую активность в отношении гембелка, определяемую временем взаимодействия с модификатором, проявляли амикацин, ципрофлоксацин, ванкомицин в терапевтических концентрациях. На клеточном уровне такие процессы взаимодействия антибиотиков с биологическими объектами способствуют изменению эластичности мембранных структур, проницаемости для различных веществ, а также, по всей вероятности, изменению активности ряда ферментов, ответственных за активный транспорт веществ, биоэлектрогенез, проведение нервного импульса и другое. По этой причине исследование механизмов взаимодействия антибактериальных препаратов с биомолекулами является очень важным для понимания механизмов, лежащих в основе нарушений структурно – функциональных свойств биологических систем различного уровня организации.

