Изучение белок-белковых взаимодействий консервативного в эволюции транскрипционного фактора ENY2
Конференция: X Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Молекулярная биология

X Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Изучение белок-белковых взаимодействий консервативного в эволюции транскрипционного фактора ENY2
Study of evolutionary conserved transcription factor ENY2 physical interactions
Julia Nikolenko
Ph.D, researcher, Federal State Budget Institution of Sciences Institute of Gene Biology,Russian Academy of Sciences, Russia, Moscow
Alexey Krasnov
Ph.D,leading researcher, Federal State Budget Institution of Sciences Institute of Gene Biology, Russian Academy of Sciences, Russia, Moscow
Данная работа была поддержана грантом Российского фонда фундаментальных исследований №18-04-01019.
Аннотация. В настоящей работе был проведен скрининг белков, взаимодействующих с транскрипционным фактором ENY2 в дрожжевой двугибридной системе. Были обнаружены белки, взаимодействующие с белками ENY2 в протеоме Drosophila melanogaster и человека. ENY2 - важный консервативный фактор, функционирующий на нескольких разных стадиях регуляции экспрессии генов. Дальнейшее изучение обнаруженных нами взаимодействий поможет пролить свет на механизмы его работы.
Abstract. In the present work, the proteins interacting with the transcription factor ENY2 in the yeast two-hybrid system were screened. Proteins interacting with ENY2 in the proteome of Drosophila melanogaster and human were detected. ENY2 is an important conservative factor that functions at several different stages in the regulation of gene expression. Further study of the interactions discovered in the present study will help shed light on the mechanisms of its operation.
Ключевые слова: экспрессия генов; регуляция транскрипции; двугибридная систем; ENY2.
Keywords: gene expression; regulation of transcription; Two-hybrid screening; ENY2.
Регуляция экспрессии генов в процессе развития – одна из центральных проблем молекулярной биологии. Ранее в нашей лаборатории были открыты и охарактеризованы гены Drosophila melanogaster, названные enhancerofyellow ( е(у) ), которые кодируют белки, вовлеченные на разных стадиях в регуляцию транкрипции [2, 10, 14, 15, 16, 19]. Ген е(у)2, кодирующий белок ENY2, активно транскрибируется на всех стадиях развития Drosophila melanogaster. Белок ENY2 имеет ядерную локализацию и присутствует на всех стадиях развития и во всех тканях имаго. Было обнаружено, что ENY2 консервативен в эволюции и присутствует у всех многоклеточных организмов от простейших до человека. Белки ENY2 у всех организмов имеют сходное строение [6]. Область гомологии распределена по всей аминокислотной последовательности, хотя можно выявить и несколько особенно консервативных участков. Белки дрозофилы и человека имеют длину 101 а.о., 56,4 % идентичных и 37,3 % подобных а.о., область гомологии белков представлена на Рис.1. Изучение функционирования ENY2 Drosophila melanogaster выявило его участие в экспрессии генов на разных стадиях от инициации транскрипции до экспорта мРНК из ядра [8, 9].
Белок-белковые взаимодействия лежат в основе огромного спектра биохимических процессов. Идентификация белков, взаимодействующих с исследуемым белком, является важнейшим аспектом изучения функционирования и регуляции данного белка. Одним из методов, играющих огромную роль в процессах поиска взаимодействующих белков, является метод скрининга в дрожжевой двугибридной системе. Этот метод был разработан на основе исследований активаторов транскрипции. Сайт-специфические транскрипционные факторы часто имеют отдельные функционально-независимые домены: ДНК-связывающий домен (BD) и домен активации транскрипции (AD) [18].

Рисунок 1. Область гомологии белков ENY2 Drosophila melanogaster и человека
BD взаимодействует со специфическими энхансер-подобными последовательностями, а AD направляет комплекс РНК-полимеразы II на транскрипцию подконтрольных генов. Оба домена BD и AD необходимы для активации транскрипции гена, и в норме, например, в случае дрожжевого активатора Gal4, они являются частями одного белка. Если физически разделить BD и AD и ко-экспрессировать их в клетках дрожжей, BD и AD-пептиды не будут непосредственно контактировать друг с другом, и следовательно, не смогут активировать транскрипцию. Однако, если BD и AD смогут оказаться в тесном контакте друг с другом вблизи промотора, их способность индуцировать транскрипцию восстановится. В двугибридной системе два предположительно взаимодействующих белка X и Y сшиваются в единой рамке трансляции с BD и AD какого-либо активатора транскрипции. Белок X, сшитый с BD, обозначается как Bait (приманка), а белок Y, сшитый с AD, – Prey (добыча). Рекомбинантные белки X-BD и Y-AD ко-экспрессируются в дрожжах. Взаимодействие X и Y приводит к восстановлению функции активатора, который взаимодействует со специфическими для него сайтами связывания, расположенными перед промоторной областью репортерных генов, экспрессия которых может быть легко детектирована (Рис.2). Если X и Y не взаимодействуют друг с другом, транскрипции репортерных генов не происходит.
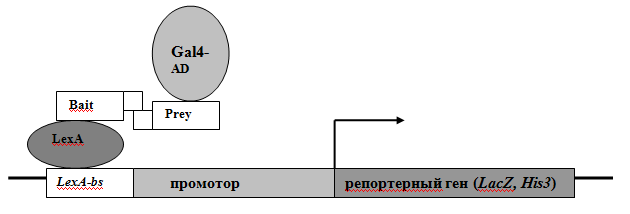
Рисунок 2 Принцип двугибридного метода
Мы в своей работе использовали штамм дрожжей L40, дефектный по биосинтезу гистидина. Взаимодействие белков Bait и Prey в клетках этого штамма вызывает активацию двух репортерных генов: дрожжевого гена HIS3 и бактериального гена LacZ. Оба репортерных гена экспрессируются под контролем операторов бактериального ДНК-связывающего белка LexA. В качестве домена активации транскрипции мы использовали AD дрожжевого активатора Gal4. В качестве положительного контроля была использована конструкция, которая кодировала слитный полипептид LexA-GAL4_AD, содержащий активационный домен GAL4 в единой рамке трансляции с LexA. Мы субклонировали ENY2 человека и Drosophila melanogaster в единой открытой рамке считывания с LexA в векторе pBTM117c и провели скрининг библиотек кДНК, соответственно, D. melanogaster и человека в векторе pACT2. Одним из основных недостатков метода двугибридного скрининга является большое количество ложноположительных результатов. Активация репортерного гена может наблюдаться и при отсутствии взаимодействия между двумя белками Bait и Prey, в случае, если Bait способен самостоятельно активировать транскрипцию. Такая возможность была проверена и исключена нами на предварительной стадии эксперимента. Ещё одной причиной ложно-положительных результатов может быть самостоятельное взаимодействие Prey с ДНК перед промоторной областью репортерного гена либо с белками, взаимодействующими с промотором. Использование двух независимых репортерных генов и отбор только тех клонов, в которых были активированы оба гена, позволили элиминировать такие ложно-положительные клоны. Повторяющиеся кДНК клоны были элиминированы методом ПЦР индивидуальных дрожжевых колоний и последующей Southern-гибридизации. Плазмиды, содержащие уникальные кДНК клоны, были выделены из дрожжей, трансформированы в E. coli и после наращивания выделены в препаративных количествах для дальнейшего рестриктного анализа и секвенирования. Анализ нуклеотидных последовательностей клонов проводился при помощи программы BLAST на сервере NCBI.
Таблица 1.
Результат двугибридного скрининга
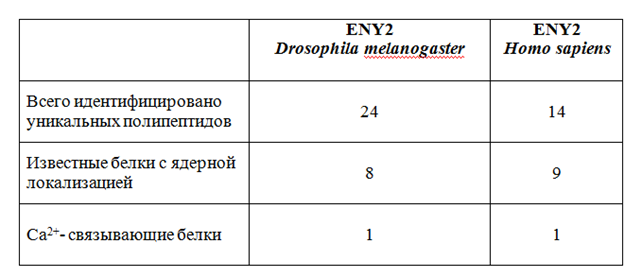
Результаты проведенного двугибридного скрининга представлены в Табл. 1. Было идентифицировано 24 и 14 уникальных клонов, кодирующих белки, взаимодействующие с ENY2 Drosophila melanogaster и человека, соответственно. Некоторые из них - гипотетические белки с еще неизвестными функциями, предсказанные по последовательности кДНК. Интересно, что в обоих скринингах были обнаружены белки, способные связывать ионы Ca2+. 8 и 9 клонов, соответственно, кодируют известные белки с ядерной локализацией. Изучение взаимодействия ENY2 с последними представляется нам наиболее перспективным. Наибольший интерес представляет дальнейшее изучение взаимодействия ENY2 Drosophilamelanogaster и РНК-хеликазы MLE(Maleless). Это взаимодействие оказалось эволюционно консервативным: мы детектировали его в обоих проведенных скринингах. Друг с другом связывались белки DrosophilamelanogasterdENY2 и MLE, а также их гомологи в протеоме человека hENY2 и RHA. В обоих случаях за взаимодействие с ENY2 отвечал С-концевой район молекулы хеликазы, не содержащий известных доменов и обогащенный остатками глицина, тирозина и аргинина. Такая консервативность в эволюции указывает на важность обнаруженного взаимодействия. MLE и RHA - это мультидоменные белки, относящиеся к семейству РНК-хеликаз, содержащих домен DEAD box. Представители этого семейства способны расплетать двухцепочечную РНК и РНК-ДНК гибриды и ремоделировать шпильки в одноцепочечной РНК. Эта активность хеликаз необходима в процессах регуляции транскрипции, сплайсинга, ядерного экспорта и инициации трансляции. Хеликаза MLE была обнаружена и до последнего времени изучалась, как компонент комплекса дозовой компенсации [11, 17].
Однако, MLE присутствует в соматических клетках как самцов, так и самок (т. е. вне комплекса дозовой компенсации), и за последние годы были получены данные о том, что MLE вовлечена в такие разнообразные процессы, как экспрессия генов гетерохроматина, процессинг РНК в ходе РНК-интерференции, взаимодействие с комплексом ремоделирования хроматина NURD и др. [3,4,20]. Для RHA [12] также было показано участие в широком спектре процессов, таких как сайленсинг генов, регуляция EGFR-опосредованной транскрипции [7] и инициации трансляции [13].
Получены данные об участии RHA в патогенезе ВИЧ-инфекции [1] и в процессах злокачественной трансформации [5]. Молекулярные механизмы перечисленных процессов к настоящему моменту мало изучены. Обнаруженное нами взаимодействие MLE и ENY2 открывает широкие возможности для дальнейших исследований.


