Структура хроматина на Su(Hw)-зависимых инсуляторах
Конференция: X Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Молекулярная биология

X Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Структура хроматина на Su(Hw)-зависимых инсуляторах
Chromatin structure on Su(Hw)-dependent insulators
Julia Nikolenko
PhD, researcher Institute of Gene Biology RAS, Russia, Moscow
Marina Mazina
PhD, researcher Institute of Gene Biology RAS, Russia, Moscow
Nadezhda Vorobyeva
PhD, senior researcher Institute of Gene Biology RAS, Russia, Moscow
Aleksey Krasnov
PhD, leading researcher Institute of Gene Biology RAS, Russia, Moscow
Данная работа была поддержана грантом РФФИ 17-04-02193.
Аннотация. Белок Su(Hw) необходим для работы хорошо известных инсуляторов Drosophila. Мы показали, что Su(Hw) привлекает комплекс ацетилирования гистонов SAGA и ремоделирующий комплекс SWI/SNF на Su(Hw)-зависимые инсуляторы, что приводит к формированию регионов с низкой плотностью нуклеосом.
Abstract. The Su(Hw) protein accounts for the activity of best-studied Drosophila insulators. Here, we show that Su(Hw) recruits the histone acetyltransferase complex SAGA and chromatin remodeler SWI/SNF to Su(Hw)-dependent insulators, which gives rise to regions with low nucleosome density.
Ключевые слова: Su (Hw); инсуляторы; SAGA; SWI/SNF; гистоны.
Keywords: Su (Hw); insulators; SAGA; SWI/SNF; histones.
Введение. Белок Su (Hw) содержит домен цинковых пальцев и необходим для функционирования хорошо известных инсуляторов дрозофилы (1). Еще два белка, Mod(mdg4) и CP190 необходимы для инсуляторной функци. Белок ENY2 привлекается посредством Su (Hw) на инсуляторы и необходим для барьерной функции Su (Hw)-зависимых инсуляторов (2). ENY2 это небольшой белок и играет важную роль в регуляции транскрипции, будучи субъединицей DUB модуля SAGA комплекса Drosophila (3-5).
SAGA комплекс это высококонсервативный транскрипционный коактиватор, который состоит более чем из 20 субъединиц (6). Комплекс SAGA привлекается на промоторы генов путем взаимодействия с ДНК-связывающими транскрипционными факторами (7). Ацетилирование нуклеосом на промоторе с помощью SAGA комплекса необходимо для их последующего удаления с помощью комплекса ремоделинга SWI/SNF (8, 9).
SWI/SNF это ATP-зависимый комплекс ремоделирования хроматина, который осуществляет ключевые функции в регуляции экспрессии генов. Комплекс SWI/SNF содержит бромодомен, который узнает ацетилированный гистоны. Присутствие бромодомена в SWI/SNF комплексе подтверждает функциональную связь между ацетилированием гистонов и ремоделингом хроматина. BAP и PBAP это два основных субкласса SWI/SNF у дрозофилы. Оба этих комплекса содержат общие субъединицы, включая АТФ-азу, и отличаются рядом субъединиц, которые характеризуют соответствующие комплексы: POLYBROMO, BAP170 и SAYP специфичны для PBAP комплекса, в то время как, субъединица OSA специфична для BAP (10,11).
Результаты. Как показано в наших предыдущих исследованиях, белок ENY2 связывается с доменом цинковых пальцев белка Su (Hw) и рекрутируется на инсуляторный комплекс (2). Так как белок ENY2 является компоненом SAGA комплекса (3), было логичным проверит привлечение SAGA на Su (Hw)-зависимые инсуляторы. Для этого мы протестировали присутствие белка GCN5, каталитической субъединицей комплекса SAGA, на сайтах связывания Su (Hw) с помощью иммунопреципитации хроматина (ChIP). Мы использовали линию мух дикого типа (wt) и мутантную линию мух Su (Hw)V/E8. Мухи, несущие данную мутация, продуцируют белок Su (Hw), который неспособен связываться со своими таргетными последовательностями.
Куколки мутантной линии были протестированы в ChIP эксперименте с использованием антител к Su(Hw). В качестве контроля использовали куколок дикой линии. Были проанализированы Su (Hw)-связывающие сайты, а также ряд контрольных сайтов. Было показано, что Su (Hw) присутствует на всех сайтах связывания в куколках дикого типа и отсутствует на этих же сайтах в мутантной линии (Рисунок 1А). Для исследования привлечения комплекса SAGA на сайты связывания Su(Hw), мы провели ChIP эксперимент с использованием антител к белку GCN5. Как и в предыдущем случае, GCN5 привлекается на сайты связывания Su(Hw) в линии дикого типа, в то время как в мутантной линии, уровень GCN5 на всех этих сайтах существенно снижен (Рисунок 1Б). При этом, мутация Su(Hw) не оказывает влияния на уровень GCN5 на CTCF-зависимом инсуляторе Mcp (Рисунок 1Б). Таким образом, мы показали, что Su(Hw) необходим для привлечения SAGA комплекса на Su(Hw)-зависимые инсуляторы дрозофилы.
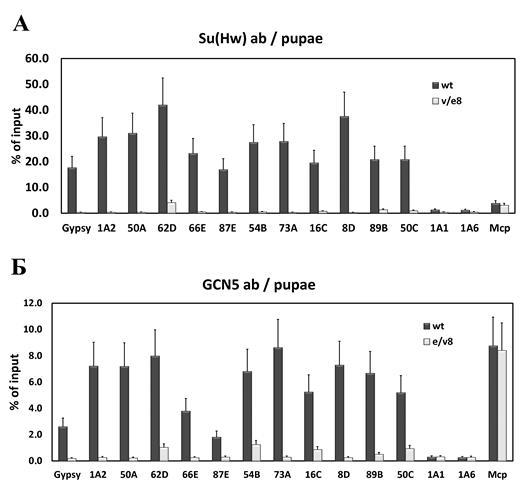
Рисунок 1. Результаты ChIP эксперимента белка Su(Hw) (панель А) и белка GCN5 (панель Б) в линии дикого типа (wt)
и мутантной линии (e/v8). Сайты от Gypsy до 50С - сайты связывания Su(Hw), 1A1 и 1A6 - отрицательные контроли, Mcp – CTCF зависимый инсулятор
Известно, что комплексы SAGA и SWI/SNF играют важную роль в модификации гистонов и ремоделинге хроматина на промоторах активных генов (12-17). Поскольку мы обнаружили SAGA сайтах Su (Hw), было важно исследовать привлечение комплекса SWI/SNF на эти сайты. Для этого мы поставили ChIP эксперимент в линии дикого типа и мутантоной линии с использованием антител к белку OSA, который является субъединицей комплекса SWI/SNF. Результаты ChIP эксперимента подтвердили привлечение белка OSA на сайты Su(Hw) (Рисунок 2A, темные столбики). OSA также привлекается на Mcp инсулятор (Рисунок 2A), что находится в соответствии с известными данными о том, что CTCF-зависимые инсуляторы обогащены комплексом SWI/SNF (18). В мутантной линии было обнаружено существенное уменьшение уровня OSA (Рисунок 2A, светлые столбики) на сайтах Su (Hw). При этом, мутация Su (Hw) не оказывает влияния на уровень OSA на CTCF-зависимом инсуляторе Mcp. Таким образом, мы обнаружили, что комплекс SWI/SNF привлекается на сайты Su (Hw) и Su (Hw) необходим для этого привлечения, как и в случае с SAGA комплексом.
Поскольку мы обнаружили комплексы SAGA и SWI/SNF на сайтах связывания Su (Hw), было важно посмотреть, имеет ли место ремоделинг хроматина на этих сайтах. Для этого мы провели ChIP эксперимент с использованием антител к гистону H3 в линии дикого типа и мутантной линии. Эксперимент показал, что уровень гистона H3 на сайтах Su (Hw) ниже, чем на контрольных сайтах 1A1 and 1A6 (Рисунок 2Б, темные столбики). Этот результат согласуется с известными данными о том, что для сайтов связывания инсуляторных белков характерна пониженная плотность нуклеосом (19). Анализ уровня гистона H3 в мутантной линии показал значительно более высокий уровень, по сравнению с линией дикого типа (Рисунок 2Б, светлые столбики), в то время как уровень гистона H3 на MCP-инсуляторе остался неизменным. Можно заключить, что Su (Hw) необходим для ремоделинга хроматина на своих сайтах.
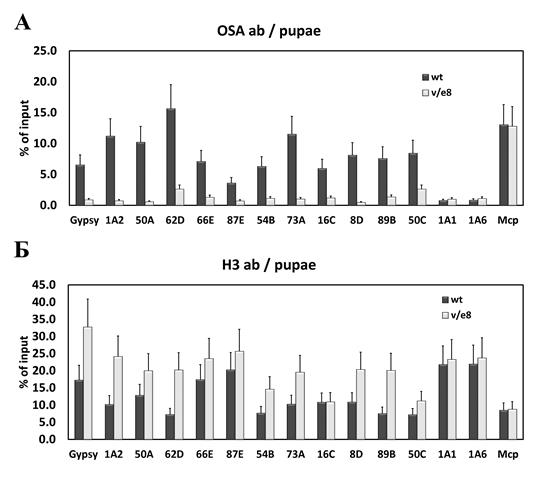
Рисунок 2. Результаты ChIP эксперимента белка OSA (панель А) и гистона H3 (панель Б) в линии дикого типа (wt)
и мутантной линии (e/v8). Сайты от Gypsy до 50С - сайты связывания Su(Hw), 1A1 и 1A6 - отрицательные контроли, Mcp – CTCF зависимый инсулятор
Чтобы подтвердить данный результат на полногеномном уровне мы разработали программное обеспечение, которое позволяет строить усредненные геномные профили на любом наборе геномных позиций. Мы идентифицировали точные позиции около 3000 сайтов Su(Hw) в геноме дрозофилы и затем вычислили усредненное геномное распределение гистонов H1, H3 и H4 в регионе –5 kb и +5 kb относительно Su (Hw) пика. Этот подход позволяет визуализировать ChIP-Seq данные и вычисляет средний уровень исследуемого фактора на сайтах Su (Hw) относительно окружающих последовательностей. Полногеномный анализ показал, что сайты связывания Su (Hw) это действительно области с пониженной плотностью нуклеосом (Рисунок 3).
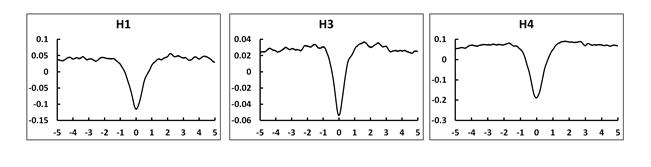
Рисунок 3. Полногеномный анализ уровня (log2 обогащения) гистонов H1, H3 и H4 в регионе –5 kb и +5 kb
относительно Su (Hw) пика. Позиция Su(Hw) в точке 0
Таким образом мы показали, что Su(Hw) привлекает комплекс ацетилирования гистонов SAGA и ремоделирующий комплекс SWI/SNF на Su(Hw)-зависимые инсуляторы, что приводит к формированию регионов с низкой плотностью нуклеосом.


