Биоплёнки Staphylococcus aureus в медицинской практике. Образование биоплёнок S. aureus на полиэтилентерефталате в лабораторных условиях
Конференция: XLVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Микробиология

XLVII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Биоплёнки Staphylococcus aureus в медицинской практике. Образование биоплёнок S. aureus на полиэтилентерефталате в лабораторных условиях
STAPHYLOCOCCUS AUREUS BIOFILMS IN MEDICAL PRACTICE.
BIOFILM FORMATION OF S. AUREUS ON POLYETHYLENE TEREPHTHALATE UNDER LABORATORY CONDITIONS
Alexandra Kuzmitskaya
Student of the Master's Degree, Department of Biotechnology, Mendeleev University of Chemical Technology, Russia, Moscow
Daria Ugarova
Ambulance paramedic, the SBI of health care of the Moscow region «Moscow regional ambulance station», Russia, Moscow
Anna Zhilina
Undergraduate student, Department of Biotechnology, Mendeleev University of Chemical Technology, Russia, Moscow
Sofya Saltykova
Student of the Master's Degree, Department of Molecular and Cellular Biology, MIPT, Russia, Moscow
Daniil Poberezhniy
Postgraduate, lead engineer, Department of Biotechnology, Mendeleev University of Chemical Technology, Russia, Moscow
Sergey Kalenov
Candidate of Engineering Sciences, docent, Department of Biotechnology, Mendeleev University of Chemical Technology, Russia, Moscow
Аннотация. Staphylococcus aureus является возбудителем множества заболеваний и обладает способностью образовывать биоплёнки на поверхности различных медицинских изделий, в том числе изготовленных из PET. Колонизация бактериями поверхности полимерного имплантата приводит к нарушению его функций и развитию инфекционных процессов в организме. Переход микроорганизмов из свободного планктонного состояния в состояние биоплёнки – сложный, труднорегулируемый процесс, зависящий от многих факторов. В лабораторных условиях с целью проведения дальнейших исследований была получена биоплёнка S. aureus на поверхности полиэтилентерефталата.
Abstract. Staphylococcus aureus causes many diseases and has the ability to form biofilms on the surfaces of various medical devices, including those made from PET. Bacterial colonization of the surface of the polymer implant leads to impairment of its functions and the development of infectious processes in the body. The transition of microorganisms from a free planktonic state to a biofilm state is a complex, difficult to regulate process that depends on many factors. The biofilm of S. aureus on the surface of polyethylene terephthalate has been obtained under laboratory conditions for the purpose of further research.
Ключевые слова: Staphylococcus aureus; биоплёнки; кворум-сенсинг; полиэтилентерефталат.
Keywords: Staphylococcus aureus; biofilms; quorum sensing; polyethylene terephthalate.
Staphylococcus aureus – неподвижные, грамположительные, факультативно анаэробные кокки, расположенные поодиночке или кластерами в виде «гроздьев винограда». Они хорошо растут на питательных средах с повышенным содержанием NaCl (~10-15%). Образуют выпуклые, гладкие, блестящие, полупрозрачные колонии жёлтого цвета, с ровными краями [1].
С медицинской точки зрения Staphylococcus aureus является важным для исследований модельным объектом. Обычно это доброкачественные комменсалы наружных покровов тела человека, но довольно опасные при проникновении внутрь организма. Вызывают широкий спектр заболеваний: от незначительных кожных инфекций (фурункулёз, импетиго, фолликулит и др.) до смертельных болезней (например, эндокардит, синдром токсического шока, сепсис) [2].
Возбудителями многих нозокомиальных инфекций являются штаммы золотистого стафилококка, обладающие множественной антибиотической устойчивостью (MRSA – multidrug-resistant S. aureus). Дыхательные, мочевыводящие пути, раны и кровоток являются основными очагами внутрибольничных инфекций. Пациенты, которым была проведена катетеризация или которым потребовалось хирургическое вмешательство, подвержены более высокому риску инфицирования [3].
Бактериальные инфекции, связанные с имплантами, в зависимости от происхождения классифицируются на: периоперационные (бактериальная колонизация во время операции), смежные (заражение раны) и гематогенные (распространение бактерий через кровь и лимфатические узлы) [4].
S. aureus образует биоплёнки на поверхностях многих предметов, включая внутрисосудистые устройства и импланты. Клетки при этом прикреплены и к поверхности объекта, и друг к другу. Формирование биоплёнок микроорганизмов определяется: типом самих микроорганизмов, доступностью питательных веществ, характеристиками субстрата, к которому они прикрепляются. Осаждение белков организма-хозяина на поверхности медицинского устройства происходит сразу же после его размещения внутри тела, что в дальнейшем приводит к необратимому прикреплению бактерий и образованию ими биоплёнок. После достижения значительной плотности популяции некоторые фрагменты биоплёнки могут отсоединяться, распространяясь кровотоком по всему организму. Связанные с имплантатами биоплёнки нарушают их нормальное функционирование и вызывают развитие инфекционных процессов [4], [5].
Одним из механизмов, определяющих созревание и распространение биоплёнок Staphylococcus aureus, является кворум-сенсинг (QS – quorum sensing). Бактерии общаются посредством производства диффундирующих сигнальных молекул, называемых аутоиндукторами. Эти молекулы производятся на базальном уровне и накапливаются во время роста микроорганизмов. После достижения критической концентрации аутоиндукторы могут активировать или репрессировать ряд генов-мишеней. Контроль экспрессии генов с помощью аутоиндукторов зависит от плотности клеток в популяции. Кворум-сенсинг позволяет S. aureus проводить мониторинг окружающей среды на предмет наличия других бактерий и регулировать своё «поведение» в масштабах всей популяции в ответ на изменение её численности или появление новых видов, входящих в состав сообщества [6].
Грамположительные бактерии общаются, используя модифицированные олигопептиды в качестве аутоиндукторов (АИП) и двухкомпонентные мембраносвязанные сенсорные гистидинкиназы в качестве рецепторов. Передача сигналов опосредуется каскадом фосфорилирования, который влияет на активность ДНК-связывающего транскрипционного регуляторного белка, называемого регулятором ответа. Пептиды не могут свободно диффундировать через мембрану, следовательно, их высвобождение опосредуется специализированными белками-экспортёрами. В большинстве случаев выделение олигопептидов сопровождается их обработкой и модификацией, т.е. процессингом (превращением в АИП). Стратегия, которую использует Staphylococcus aureus, состоит в следующем: (1) при низкой плотности популяции вырабатываются адгезины, которые помогают бактериям прилипать к поверхности имплантата; (2) при высокой плотности популяции репрессируется ген-регулятор, производится больше токсинов, которые повреждают окружающие ткани, и ферментов, которые помогают бактериям отделиться от биоплёнки и колонизировать новые участки [7].
Полиэтилентерефталат (PET) является одним из самых распространённых полимеров, широко используемых в биомедицинских технологиях. Это термопластичный полиэфир, состоящий из двух мономеров: этиленгликоля и терефталевой кислоты. Получают его переэтерификацией диметилтерефталата с этиленгликолем. Применение PET в клинической практике включает в себя: волокна, нити, сердечные клапаны, хирургические сетки, каркасы, мочевые катетеры и катетеры кровотока. Биосовместимость, высокая однородность, механическая прочность, устойчивость к химическим веществам и истиранию – всё это делает полиэтилентерефталат перспективным материалом для многих направлений биомедицины [8-10]. Тем не менее, поверхности PET подвержены контаминации микроорганизмами. Так, Staphylococcus aureus считается основным источником инфекционных процессов, связанных с сердечными клапанами и желудочковыми вспомогательными устройствами [4], [11].
В биоплёнках присутствуют внеклеточные полимерные вещества (EPS – extracellular polymeric substances), экспрессируемые бактериями и материалом поверхности медицинского изделия. Развитый EPS-матрикс формирует барьер, устойчивый к воздействию антибиотиков. Бактерии, находясь под защитой EPS-матрикса, необратимо прикрепляются к материалу, интенсивно размножаются и образуют зрелую биоплёнку. Большинство клеток в матрице зрелой биоплёнки находятся в «спящем состоянии» или медленно реплицируются. Когда бактерии внутри биоплёнки имеют медленную скорость роста, транспорт антибиотиков в биоплёнку тоже снижается. Например, чтобы уменьшить количество колоний Staphylococcus aureus в биоплёнке в 1000 раз, необходимо увеличить минимальную бактерицидную концентрацию антибиотика ванкомицина более чем в 10 раз [4], [11-12].
Был проведён эксперимент по получению биоплёнки Staphylococcus aureus на поверхности PET в лабораторных условиях. В качестве посевного материала использовалась биомасса штамма S. aureus (рис. 1), вносившаяся в колбу с жидкой модифицированной питательной средой LB состава: 2 г/л дрожжевой экстракт; 10 г/л триптон; 0,2 г/л MgSO4·7H2O; 0,5 г/л NaCl. Углеводы ингибируют адгезивные способности золотистого стафилоккока [13], поэтому их содержание в питательной среде минимизировалось.
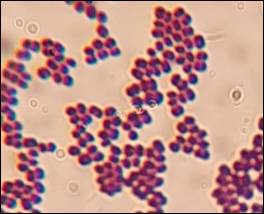
Рисунок 1. Окрашивание культуры S. aureus по Граму
В инокулированную питательную среду помещалась стерилизованная 70%-ным этиловым спиртом пластина PET размером 3×3 см, толщиной 0,03 см. С помощью абразива одному краю пластины предварительно была придана шероховатость. Культивирование осуществлялось в шейкере-инкубаторе Minitron Infors-HT при скорости перемешивания 150 об/мин и температуре 28ºC в течение 5 дней. По истечении срока культивирования на обработанном краю пластины наблюдалось активное образование биоплёнок Staphylococcus aureus (рис. 2). Из-за большей площади, доступной для адгезии, шероховатые поверхности колонизируются микроорганизмами быстрее, чем гладкие [14].

Рисунок 2. Образование биоплёнки S. aureus на поверхности PET-пластины
a) – через 1 сутки после начала культивирования б) – через 5 суток после начала культивирования
Полученная система S. aureus-полиэтилентерефталат может служить основой для дальнейшего изучения динамики развития биоплёнок Staphylococcus aureus, влияния на них различных антибиотиков, пептидов или супернатантов штаммов микроорганизмов, которые продуцируют внеклеточные ферменты, ингибирующие развитие биоплёнок [15-17].

